You are using an out of date browser. It may not display this or other websites correctly.
You should upgrade or use an alternative browser.
You should upgrade or use an alternative browser.
۞سم شناسی مواد و عناصر شیمیایی۞
- شروع کننده موضوع fa7alveh
- تاریخ شروع
fa7alveh
کاربر ممتاز تالار شیمی
کروم (Cr)
کروم (Cr)

کروم عنصری است که غیر قابل حل در اسیدسولفوریک و اسید هیدرولیک رقیق می باشد. فلزی سخت شکننده، براق، خاکستری رنگ و در برابر زنگ زدن بسیار مقاوم است.
TLV(STEL)=cr30.5mg/m3 TLV(STEL)=cr60.05mg/m3 محلول در آب TLV(STEL)=cr6.01mg/m3 غیر محلول PEL=1mg/m3
کروم در طبیعت: کروم به صورت خالص در طبیعت یافت نمی شود و فقط تنها سنگ مهم سنگ آهن کروم دار به نام کرومیت فرو(feocr2o3) است که به صورت گسترده در معادن سطحی زمین یافت می شود.
تولید: فروکروم یا آلیاژکروم وآهن، معمولا به طریق احیاء سنگ معدن کروم به وسیله کربن در کوره الکتریکی به دست می آید. منبع اصلی تهیه ی کروم(cr2o3) با پودر آلومینیوم به روش حرارت دادن آلومینیوم با الکترولیز محلول های حاوی کروم می باشد.
مصارف: مهمترین مورد استفاده مصرف کروم خالص برای آبکاری الکتریکی قطعات اتومبیل و وسایل الکتریکی است همچنین به مقدار زیاد در تهیه ی آلیاژ ها به کار می رود.
مخاطرات: کروم در حالت 2 و 3 ظرفیتی خطر کمی دارد ولی در حالت 6 ظرفیت محرک و خورنده است و از دستگاه گوارش، پوست جذب و از طریق استنشاقی و بر دستگاه تنفسی اثر گذاشته و در موارد بسیار ایجاد سرطان ریه می کند.
از عوارض ایجاد شده توسط کروم در مواجعه های شغلی می توان به :
1- زخم کروم
2- التهاب پوستی
3- آثار حاد(روی دستگاه تنفسی)
4-زخم دیواره میانی بینی اشاره کرد.
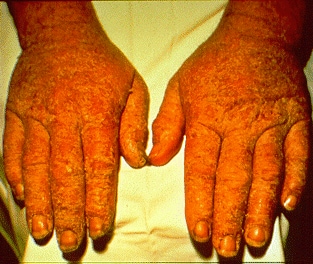
از دیگر آثار کروم پیدایش سرطان ریه در افرادی است که در کارخانه تولید دی کرومات در معدن کار می کنند امری شناخته شده است ولی هیچ روش برای تشخیص به جز مساله تماس شغلی با کرومات ها بروز سرطان در کارگران کارخانه های کرومات وجود ندارد.
تدابیر ایمن و بهداشتی:
1- طراحی مناسب فرآیند و تهویه کافی
2- استفاده از روش های نظارت مرطوب
3- استفاده از دستگاه های مکنده ها
4- تعیین غلظت ترکیب های کروم در نقاط مختلف محیط کار در فواصل زمانی مختلف
5- شست و شوی روزانه لباس کار
6- استفاده از وسایل حفاظتی مثل دستکش، ماسک (ماسک هایی که قادر به جلوگیری از عبور 90% ذرات 5/0 میکرومتر باشند)
7- استفاده از EDTA 8- چنانچه غلظت بالاتر از میزان توصیه شده باشد باید منشا تولید آن را کشف و تحت کنترل قرار دارد.
کروم (Cr)

کروم عنصری است که غیر قابل حل در اسیدسولفوریک و اسید هیدرولیک رقیق می باشد. فلزی سخت شکننده، براق، خاکستری رنگ و در برابر زنگ زدن بسیار مقاوم است.
TLV(STEL)=cr30.5mg/m3 TLV(STEL)=cr60.05mg/m3 محلول در آب TLV(STEL)=cr6.01mg/m3 غیر محلول PEL=1mg/m3
کروم در طبیعت: کروم به صورت خالص در طبیعت یافت نمی شود و فقط تنها سنگ مهم سنگ آهن کروم دار به نام کرومیت فرو(feocr2o3) است که به صورت گسترده در معادن سطحی زمین یافت می شود.
تولید: فروکروم یا آلیاژکروم وآهن، معمولا به طریق احیاء سنگ معدن کروم به وسیله کربن در کوره الکتریکی به دست می آید. منبع اصلی تهیه ی کروم(cr2o3) با پودر آلومینیوم به روش حرارت دادن آلومینیوم با الکترولیز محلول های حاوی کروم می باشد.
مصارف: مهمترین مورد استفاده مصرف کروم خالص برای آبکاری الکتریکی قطعات اتومبیل و وسایل الکتریکی است همچنین به مقدار زیاد در تهیه ی آلیاژ ها به کار می رود.
مخاطرات: کروم در حالت 2 و 3 ظرفیتی خطر کمی دارد ولی در حالت 6 ظرفیت محرک و خورنده است و از دستگاه گوارش، پوست جذب و از طریق استنشاقی و بر دستگاه تنفسی اثر گذاشته و در موارد بسیار ایجاد سرطان ریه می کند.
از عوارض ایجاد شده توسط کروم در مواجعه های شغلی می توان به :
1- زخم کروم
2- التهاب پوستی
3- آثار حاد(روی دستگاه تنفسی)
4-زخم دیواره میانی بینی اشاره کرد.

از دیگر آثار کروم پیدایش سرطان ریه در افرادی است که در کارخانه تولید دی کرومات در معدن کار می کنند امری شناخته شده است ولی هیچ روش برای تشخیص به جز مساله تماس شغلی با کرومات ها بروز سرطان در کارگران کارخانه های کرومات وجود ندارد.
تدابیر ایمن و بهداشتی:
1- طراحی مناسب فرآیند و تهویه کافی
2- استفاده از روش های نظارت مرطوب
3- استفاده از دستگاه های مکنده ها
4- تعیین غلظت ترکیب های کروم در نقاط مختلف محیط کار در فواصل زمانی مختلف
5- شست و شوی روزانه لباس کار
6- استفاده از وسایل حفاظتی مثل دستکش، ماسک (ماسک هایی که قادر به جلوگیری از عبور 90% ذرات 5/0 میکرومتر باشند)
7- استفاده از EDTA 8- چنانچه غلظت بالاتر از میزان توصیه شده باشد باید منشا تولید آن را کشف و تحت کنترل قرار دارد.
آخرین ویرایش:
fa7alveh
کاربر ممتاز تالار شیمی
کلر ( Cl )
کلر ( Cl )

در سال 1774 Carl Wilhelm scheele کلر را کشف کرد تصور کرد این عنصر حاوی اکسیژن است Humphry Davy درسال 1810 نام کلر را برای این ماده انتخاب کرد و گفت این ماده یک عنصر است.
کلر در طبیعت : فقط به صورت ترکیب با سایر عناصر و عمدتا سدیم به شکل نمک طعام (Nacl) و در کارنالیت و سیلویت یافت می شود.
کلر عنصر شیمیایی با عدد اتمی 17 به نشان Cl می باشد و در جدول تناوبی در گروه هفتم قرار دارد بوی بد و خفه کننده دارد و بسیار سمی می باشد.
نوع خالص کلر به شکل گاز دو اتمی و سبز رنگ می باشد نام کلر بر گرفته از Chloros به معنی سبز است که اشاره به رنگ این گاز دارد.
مصارف : کلر در تصفیه آب مواد گندزدا در سفید کننده و در تولید محصولات کاغذی مواد ضد عفونی کننده رنگ دانه ها لاستیک مصنوعی کلرانها ، کلر فروم ، تتراکلرید کربن ، گازخردل وساخت طیف وسیع است از اقلام روز مره کاربرد دارد.
دو ایزومر پایدار کلر با جرم 35 و 37 وجود دارد در سطح تجاری کلر به وسیله الکترولیز کلرو سدیم به صورت آب نمک تولید می شود که سه نوع سلول برای فرایند الکترولیز به کار گرفته می شود سلول جیوه - سلول دیافراگم – سلول پوسته .
تولید : الکترولیز سلول جیوه اولین روش در تولید کلر در مقیاس صنعتی بود اما مصرف انرژی آن زیاد است سلول دیافراگم از روش سلول جیوه کم تر انرژی مصرف می کند اما هیدروکسید سدیم را به سختی می توان جمع آوری و به ماده مفید تبدیل کرد. در روش سلول پوسته تقریبا به اندازه سلول دیافراگم به صرفه بوده باز هم تولید هیدروکسید سدیم بسیار خالص می کند.
خطرات : کلر موجب تحریک دستگاه تنفسی مخصوصا در کودکان و کهنسالان می شود درحالت گاز باعث تورم غشای مخاطی شده و در حالت مایع موجب سوختگی پوست می شود مقدار 5/3 ppm آن لازم است تا به عنوان بوی متمایز شناخته شود و مقدار 1000 ppm آن کشنده است.

در جنگ جهانی اول با توجه به این خاصیت کلر، کلر به عنوان گاز جنگی مورد استفاده قرار گرفت. مواجه با این گاز نباید از 5/0 ppm فراتر رود مواجهه شدید با مقدار زیاد کلر غلیظ (اما نه به مقدار کشنده) می تواند باعث ادم ریه،(آب آوردن) که وضعیتی بسیار ناگوار است. تماس دائم با مقدار کم کلر ریه ها را ضعیف کرده و آسیب پذیری ریه ها را در برابر بیماریهای دیگر افزایش می دهد کلر همراه با هیدروژن قابلیت اشتعال و انفجار پیدا می کند.
تدابیر ایمنی و بهداشتی: اولا باید غلضت کلر را در هوا پائین تر از حد مجاز نگه داشت ثانیا در کلیه فرایندهایی که از کلر استفاده می شود باید احتیاط های لازم پیش بینی شود تا از خطرهای احتمالی- بهداشتی پیشگیری به عمل آید برای بعضی از فرایندها اقدامات اضافی برای مقابله خطر آتش سوزی و انفجار باید در نظر گرفته شود.
کلر ( Cl )

در سال 1774 Carl Wilhelm scheele کلر را کشف کرد تصور کرد این عنصر حاوی اکسیژن است Humphry Davy درسال 1810 نام کلر را برای این ماده انتخاب کرد و گفت این ماده یک عنصر است.
کلر در طبیعت : فقط به صورت ترکیب با سایر عناصر و عمدتا سدیم به شکل نمک طعام (Nacl) و در کارنالیت و سیلویت یافت می شود.
کلر عنصر شیمیایی با عدد اتمی 17 به نشان Cl می باشد و در جدول تناوبی در گروه هفتم قرار دارد بوی بد و خفه کننده دارد و بسیار سمی می باشد.
نوع خالص کلر به شکل گاز دو اتمی و سبز رنگ می باشد نام کلر بر گرفته از Chloros به معنی سبز است که اشاره به رنگ این گاز دارد.
مصارف : کلر در تصفیه آب مواد گندزدا در سفید کننده و در تولید محصولات کاغذی مواد ضد عفونی کننده رنگ دانه ها لاستیک مصنوعی کلرانها ، کلر فروم ، تتراکلرید کربن ، گازخردل وساخت طیف وسیع است از اقلام روز مره کاربرد دارد.
دو ایزومر پایدار کلر با جرم 35 و 37 وجود دارد در سطح تجاری کلر به وسیله الکترولیز کلرو سدیم به صورت آب نمک تولید می شود که سه نوع سلول برای فرایند الکترولیز به کار گرفته می شود سلول جیوه - سلول دیافراگم – سلول پوسته .
تولید : الکترولیز سلول جیوه اولین روش در تولید کلر در مقیاس صنعتی بود اما مصرف انرژی آن زیاد است سلول دیافراگم از روش سلول جیوه کم تر انرژی مصرف می کند اما هیدروکسید سدیم را به سختی می توان جمع آوری و به ماده مفید تبدیل کرد. در روش سلول پوسته تقریبا به اندازه سلول دیافراگم به صرفه بوده باز هم تولید هیدروکسید سدیم بسیار خالص می کند.
خطرات : کلر موجب تحریک دستگاه تنفسی مخصوصا در کودکان و کهنسالان می شود درحالت گاز باعث تورم غشای مخاطی شده و در حالت مایع موجب سوختگی پوست می شود مقدار 5/3 ppm آن لازم است تا به عنوان بوی متمایز شناخته شود و مقدار 1000 ppm آن کشنده است.

در جنگ جهانی اول با توجه به این خاصیت کلر، کلر به عنوان گاز جنگی مورد استفاده قرار گرفت. مواجه با این گاز نباید از 5/0 ppm فراتر رود مواجهه شدید با مقدار زیاد کلر غلیظ (اما نه به مقدار کشنده) می تواند باعث ادم ریه،(آب آوردن) که وضعیتی بسیار ناگوار است. تماس دائم با مقدار کم کلر ریه ها را ضعیف کرده و آسیب پذیری ریه ها را در برابر بیماریهای دیگر افزایش می دهد کلر همراه با هیدروژن قابلیت اشتعال و انفجار پیدا می کند.
تدابیر ایمنی و بهداشتی: اولا باید غلضت کلر را در هوا پائین تر از حد مجاز نگه داشت ثانیا در کلیه فرایندهایی که از کلر استفاده می شود باید احتیاط های لازم پیش بینی شود تا از خطرهای احتمالی- بهداشتی پیشگیری به عمل آید برای بعضی از فرایندها اقدامات اضافی برای مقابله خطر آتش سوزی و انفجار باید در نظر گرفته شود.
fa7alveh
کاربر ممتاز تالار شیمی
بنزن ( C6H6 )
بنزن ( C6H6 )

مشخصات فیزیکی – شیمیایی : مایعی است بدون رنگ با بوی معطر، نقطه جوش آن در فشار یک اتمسفر 80 درجه سانتیگراد بوده و در 5 درجه سانتیگراد منجمد می گردد. دانسیته آن در (20˚C /879) و بمقدار جزیی در آب محلول می باشد.
موارد مصرف: جهت تهیه شوینده ها، لاستیکها، نایلونها، رزینها و داروها استفاده می گردد.
تأثیر بر انسان: خطر عمده در اثر تنفس بخارات بنزن بوجود می آید. تنفس بخارات در مقادیر بالا باعث مسمومیت حاد شده و منجر به تهوع، سردرد و سرگیجه می گردد.

درجه آتشگیری: قابلیت اشتعال بنزن مایع بالاست، نقطه اشتعال آن 11 درجه سانتیگراد و در 580 درجه سانتیگراد خودبخود آتش می گیرد. بخارات آن بصورت مخلوط بـا هوا قابل انفجار است. حـداقـل میزان قابل انفجار (3/1%LEL) و حـداکثر آن UEL (%7/1) می باشد.
واکنشهای خطرناک:ندارد.
نحوه تخلیه به اتمسفر و محیط: بخارات اضافی بنزن در واحدهای عملیاتی از طریق یک سیستم بسته جهت سوختن به مشعل یا کوره سوخت مواد زائد هدایت می شوند. در صورتی که فشار بخارات بنزن در داخل مخازن بالا رود از طریق PV همراه با ازت به اتمسفر تخلیه می شود.
میزان مجاز انتشار: حداکثر میزان تماس مجاز (T.L.V) برای بنزن PPM 1 می باشد.
مراقبتهای ویژه در زمان جابجائی و انبارش: از منابع حرارتی دور نگه داشته شود. از تماس با چشمها، پوست، لباس و نیز استنشاق بخارات آن جلوگیری شود.
تجهیزات و لوازم حفاظت فردی: هنگام تماس با بنزن استفاده از لوازم و تجهیزات فردی شامل دستکش PVC، چکمه، پیش بند، عینک PVC (GOGGLES) ونقاب صورت (FACE SHIELD) الزامی است در صورتی که غلظت بخارات بنزن بیش از میزان TLV باشد بایستی از دستگاه تنفسی هوای فشرده استفاده نمود.
اطلاعات مورد نیاز در زمان نشت یا سرریز مواد: در صورت نشت و یا سرریز، حتی الامکان از مصرف آب بر روی بنزن خودداری شود. در صورت نیاز برای پیشگیری از جاری شدن آن از خاک، شن وماسه نرم استفاده شود.
تأثیر تخلیه در سیستمهای فاضلاب: خاصیت سمی داشته و احتمال ایجاد انفجار در این سیستم را افزایش می دهد.
نحوه دورریز (نحوه از بین بردن): در صورت امکان جمع آوری، بازیافت و یا سوزانده شود.
نحوه مقابله با آتش سوزی: در آتش سوزی های کوچک از خاموش کننده های CO2 و یا پودر حریق و در آتش سوزی های بزرگ از کف جهت خاموش کردن آتش استفاده شود.
مشتقات بنزن فشار بالا و نقطه جوش پایین هستند که با افزایش وزن مولکولی افزایش می یابد. این حلال دارای دانسیته بخار بالا هستند. بیشتر این ترکیبات به عنوان مواد شیمیایی اولیه یا واسطه در ترکیبات دیگر بکار می روند. حلال های آلی همچنین در هزاران صنعت و شغل مثل تولید رنگ، رزین و مواد دارویی، چاپ، ریش و چسب ها و ساخت لاستیک و ... بکار می رود.
بنزن ( C6H6 )

مشخصات فیزیکی – شیمیایی : مایعی است بدون رنگ با بوی معطر، نقطه جوش آن در فشار یک اتمسفر 80 درجه سانتیگراد بوده و در 5 درجه سانتیگراد منجمد می گردد. دانسیته آن در (20˚C /879) و بمقدار جزیی در آب محلول می باشد.
موارد مصرف: جهت تهیه شوینده ها، لاستیکها، نایلونها، رزینها و داروها استفاده می گردد.
تأثیر بر انسان: خطر عمده در اثر تنفس بخارات بنزن بوجود می آید. تنفس بخارات در مقادیر بالا باعث مسمومیت حاد شده و منجر به تهوع، سردرد و سرگیجه می گردد.

درجه آتشگیری: قابلیت اشتعال بنزن مایع بالاست، نقطه اشتعال آن 11 درجه سانتیگراد و در 580 درجه سانتیگراد خودبخود آتش می گیرد. بخارات آن بصورت مخلوط بـا هوا قابل انفجار است. حـداقـل میزان قابل انفجار (3/1%LEL) و حـداکثر آن UEL (%7/1) می باشد.
واکنشهای خطرناک:ندارد.
نحوه تخلیه به اتمسفر و محیط: بخارات اضافی بنزن در واحدهای عملیاتی از طریق یک سیستم بسته جهت سوختن به مشعل یا کوره سوخت مواد زائد هدایت می شوند. در صورتی که فشار بخارات بنزن در داخل مخازن بالا رود از طریق PV همراه با ازت به اتمسفر تخلیه می شود.
میزان مجاز انتشار: حداکثر میزان تماس مجاز (T.L.V) برای بنزن PPM 1 می باشد.
مراقبتهای ویژه در زمان جابجائی و انبارش: از منابع حرارتی دور نگه داشته شود. از تماس با چشمها، پوست، لباس و نیز استنشاق بخارات آن جلوگیری شود.
تجهیزات و لوازم حفاظت فردی: هنگام تماس با بنزن استفاده از لوازم و تجهیزات فردی شامل دستکش PVC، چکمه، پیش بند، عینک PVC (GOGGLES) ونقاب صورت (FACE SHIELD) الزامی است در صورتی که غلظت بخارات بنزن بیش از میزان TLV باشد بایستی از دستگاه تنفسی هوای فشرده استفاده نمود.
اطلاعات مورد نیاز در زمان نشت یا سرریز مواد: در صورت نشت و یا سرریز، حتی الامکان از مصرف آب بر روی بنزن خودداری شود. در صورت نیاز برای پیشگیری از جاری شدن آن از خاک، شن وماسه نرم استفاده شود.
تأثیر تخلیه در سیستمهای فاضلاب: خاصیت سمی داشته و احتمال ایجاد انفجار در این سیستم را افزایش می دهد.
نحوه دورریز (نحوه از بین بردن): در صورت امکان جمع آوری، بازیافت و یا سوزانده شود.
نحوه مقابله با آتش سوزی: در آتش سوزی های کوچک از خاموش کننده های CO2 و یا پودر حریق و در آتش سوزی های بزرگ از کف جهت خاموش کردن آتش استفاده شود.
مشتقات بنزن فشار بالا و نقطه جوش پایین هستند که با افزایش وزن مولکولی افزایش می یابد. این حلال دارای دانسیته بخار بالا هستند. بیشتر این ترکیبات به عنوان مواد شیمیایی اولیه یا واسطه در ترکیبات دیگر بکار می روند. حلال های آلی همچنین در هزاران صنعت و شغل مثل تولید رنگ، رزین و مواد دارویی، چاپ، ریش و چسب ها و ساخت لاستیک و ... بکار می رود.
fa7alveh
کاربر ممتاز تالار شیمی
سولفور یا گوگرد ( S )
سولفور یا گوگرد ( S )

گوگرد یکی از عناصر شیمیایی جدول تناوبی است که نماد آن S و عدد اتمی آن 16 میباشد. گوگرد یک نافلز فراوان بیبو، بیمزه و چند ظرفیتی است که دارای اثر قلیایی بوده و بیشتر به شکل کریستال های زرد رنگ که در کانیهای سولفید و سولفات بدست میآید شناخته شده است.
گوگرد یک عنصر حیاتی و لازم برای تمامی موجودات زنده می باشد که مورد نیاز اسیدآمینهها و پروتئینها هم است. این عنصر به صورت اولیه در کودها استفاده میشود ولی بصورت گسترده تر در باروت، ملین ها، کبریت ها و حشره کش ها بکار گرفته میشود.
نام گوگرد از واژه لاتین Sulphur گرفته شده است. این عنصر تنها شبه فلزی است که از دیرباز به دلیل شکل طبیعی آن شناخته شده و آن را در زبان انگلیسی بریم استون (Brimstone) می نامیدند. بعلاوه گوگرد طبیعی را در گذشته کبریت می نامیدند.
گوگرد سیزدهمین عنصر فراوان در پوسته زمین است که در حدود 0.052% پوسته زمین را می سازد. همچنین گوگرد عنصری غیرفلزی از گروه ششم جدول تناوبی است که از نظر شیمیایی بسیار فعال است.
خصوصیات قابل توجه : ظاهر این نافلز به رنگ زرد کمرنگ می باشد که بسیار سبک و نرم است. این عنصر به هنگام ترکیب با هیدروژن بوی مشخصی دارد که مشابه بوی تخم مرغ فاسد شده می باشد. گوگرد با شعله آبی رنگ می سوزد و بوی عجیبی از خود ساتع می کند. گوگرد در آب حل شدنی نیست ولی در دی سولفیدکربن حل می شود.
کاربردها : این عنصر برای استفاده های صنعتی مانند تولید (H2SO4)اسیر سولفوریک برای باطریها، تولید باروت و حرارت دادن لاستیک تولید می شود. گوگرد در فرایند تولید کودهای فسفاتی به عنوان ماده ضدقارچ عمل می کند. سولفاتها در کاغذهای شستشو و خشکبار نیز کاربرد دارند. همچنین گوگرد در ساخت کبریت و آتش بازی نیز بکار گرفته می شود. تیوسولفات آمونیوم یا سدیم به عنوان عامل ثابت کننده در عکاسی کاربرد دارد. سولفات منیزیم می تواند به عنوان ماده ضد خشکی و ملین که یک مکمل منیزیم گیاهی است به کار گرفته شود.
نقش بیولوژیکی : آمینواسیدهای Cysteine, Methionine, Homocysteine و همچنین برخی از آنزیم ها حاوی گوگرد می باشند که در واقع گوگرد را به یک عنصر حیاتی برای سلول های زنده تبدیل کرده اند. ترکیبات دی سولفیدی مابین polypeptide ها در ساختار پروتئینی بسیار مهم می باشند. برخی از گونه های باکتری ها هم از سولفید هیدروژن بجای آب در فرایند فتوسنتز خود استفاده می کنند.
گوگرد توسط گیاهان بصورت ین سولفات از خاک جذب می شود و همچنین در حالت سولفید هگزافلوراید به صورت یک گاز گلخانه ای عمل می کند گوگرد یک قارچ کش و حشره کش و میکروب کش قوی است که در برخی از کارخانه جات صنعتی به عنوان حشره کش و قارچ کش و حتی میکروب کش تولید می شود. بنابراین می تواند علاوه بر آفات حشرات و قارچ ها و میکروب های مفید را هم از بین ببرد. وجود 4/1 الی 7/1 میلی گرم گوگرد در هر لیتر از هوا به فاصله نیم ساعت الی یک ساعت کشنده است.
خطرات : گوگرد در مسمومیت های حاد سبب خفگی و کبود شدن انگشتان و لب ها می شود که در این حالت بیمار نمی تواند حرف بزند و در عمل بلع مشکل دارد اما مرگ آنی ناشی از گوگرد کمتر مشاهده شده است. بیشترین حجم آلودگی هوا از گوگرد و ترکیبات آن به طور مصنوعی حاصل از فعالیت انسان ها و با سوختن زغال سنگ و نفت و علی الخصوص نفت خام ایجاد می شود.
تنفس گوگرد و پودرهای گوگردی آثار منفی تنفسی از جمله سرفه های شدید و تنگی نفس را به دنبال دارد. روند به طوری که کلا روند ورود پودرهای سولفاتی به صورت خشک به داخل ریه مکانیزم دفاعی ریه را برای دفع برخی از اجسام بزرگتر از کار می اندازد و سبب این بیماری ها می شود.
گاز طبیعی هم حاوی مقداری گوگرد یا ترکیباتی از آن است که باعث خورندگی لوله های فلزی حاوی گاز شهری می شوند که خود یکی از مهم ترین مشکلات ناشی از وجود گوگرد در گاز طبیعی شهری است.

همچنین نفت خام هم حاوی مقداری گوگرد است که وجود گوگرد در نفت خام باعث خاصیتی به نام ترش شدن نفت خام می شود. گوگرد و نیتروژن موجود در اتمسفر با دی اکسید کربن واکنش می دهند و اسید سولفوریک و اسید نیتریک را بوجود می آورند که این دو ترکیب با رطوبت اتمسفر مخلوط شده و به صورت باران اسیدی به زمین باز می گردد و اثرات زیان باری روی :
1. خاک 2. رنگ ساختمان ها 3. آب های سطحی و آبزیان 4. گیاهان و درختان 5. آثار تاریخی 6. پوست بدن (به صورت بیماری های پوستی) و 7. دستگاه تنفسی برجای می گذارد.
گوگرد از عناصر پرمقدار مصرفی روزانه در مقیاس گرم می باشد که غالبا به صورت املاح همراه با مواد غذایی وارد دستگاه گوارش می شود و پس از ورود به گردش خون و گذر از منافذ نسبتا گشاد مویرگی وارد آب بین سلولی می شوند و در مجاورت سلول ها قرار می گیرند. این مواد معدنی در آب به صورت یون درمی آیند.
بدن انسان در حدود 0.4% گوگرد دارد. قسمتی از پروتئین ها، آمینواسیدها، مخمرها، هرمون ها، ویتامین ها و انسولین را تشکیل می دهد و برای ساخت بخش های زنده و ایجاد تحول در موجودات، خیلی مهم می باشد و بیش از همه جا در پروتئین های مو و شاخ حیوانات موجود می باشد. در بافت عصبی، غضروف، استخوان و زردآب وجود دارد. وقتی مقدار گوگرد در بدن کم شود استخوان ها شکننده می شود و مو می ریزد. گوگرد از اهمیتی ویژه در غذاها برخوردار است. نخود، عدس، جو صحرایی و تخم مرغ دارای مقادیری گوگرد می باشند. در گندم به علت کمبود گوگرد کاهش کیفیت جدی تر از کاهش عملکرد است. زیرا در اثر کمبود شدید گوگرد در غذا با کاهش جدی گوگرد در آمینواسید پروتیمیس مواجه می شویم. گوگرد در ساختمان سه اسیدآمینه شرکت می کند. (اتصال آمینه اسیدها به همدیگر باعث تشکیل پروتئین می شود) تقریبا 25% از وزن بدن از گوگرد تشکیل شده است.
بیشترین غلظت این ماده در کراتین (که به موها، ناخن و پوست ما استحکام می دهد) موجود است. این ماده به نام «ماده معدنی زیبای طبیعی» خوانده می شود. زیرا بدن ما برای تهیه «گلاژن» (که باعث حالت ارتجاعی پوست و ظاهر جوانمان می شود) نیاز به گوگرد دارد.
ترکیبات: از ترکیبات مهم گوگردی اکسیدهای گوگردی هستند که در پالایشگاه ها تولید شده و از مهم ترین عوامل آلوده کننده هوا هستند. سایر ترکیبات گوگردی شامل گاز H2S که بسیار خطرناک و کشنده است، کربونیل سولفید و کربن دی سولفید که در واحدهای پالایشگاهی و تاسیسات جنبی آن ایجاد می شود هستند.
گاز سولفور دی اکسید:
که بیشتر در اثر سوخت های فسیلی مثل ذغال سنگ مصرفی نیروگاه های حرارتی و پالایشگاه ها از راه سوختن گازهای زاید مشعل اصلی در کارخانه های تولید اسیدسولفوریک و کود شیمیایی و همچنین توسط اتوموبیل ها تولید می شود. و یکی از آلوده کننده های عمده هوا است. این گاز در قسمت فوقانی دستگاه تنفسی جذب شده و باعث تورم، تحریک و ترشح مخاط می شود. اگر غلظت گاز SO2 یک «پی پی ام» باشد سبب انقباض مجرای تنفسی می شود و در افراد آسمی یا دارای تنگی نفس حتی در غلظت های 5.0 تا 25.0 PPM باعث ناراحتی ریوی می گردد. در هوای مرطوب گاز SO2 به اسید سولفوریک تبدیل می شود و خطر سوزش آوری و تحریک کنندگی آن به مراتب افزایش می یابد. این گاز برای گیاهان نیز زیان آور است. و بنابراین حد مجاز آن برای گیاهان خیلی کمتر از انسان و جانوران است. گاز SO2 در غلظت 20PPM در محیط باعث سرفه و اشک چشم می گردد و در غلظت 30PPM جدای از اشک ریزی شدید چشم بوی آن بسیار ناخوشایند است. این گاز در غلظت های 100~200PPM در هوا سلامتی انسان را به خطر می اندازد. ولی در غلظت های 600~800PPM پس از چند دقیقه سبب مرگ می شود.
کاربردهای دی اکسید گوگرد:
1- دی اکسید گوگرد به عنوان ماده سردکننده مثلا به عنوان گاز یخچال ها در گذشته مورد استفاده قرار می گرفت.
2- به عنوان ضدعفونی کننده.
3- به عنوان رنگ بر در تکنولوژی مواد غذایی
4- در صنایع نساجی و کاغذسازی برای تهیه H2SO3 و H2SO3 و NaHSO3 2
ئیدروژن سولفوره:
گاز ئیدروژن سولفوره که به مقدار کم و به عنوان یک ماده سمی و ناخواسته همراه گاز ترش به پالایشگاه ها وارد می شود، طی یک عملیات خاص و با استفاده از آمین در واحدهای پالایش از گاز ترش جدا می گردد. وجود مقادیر جزیی در حد یک هزار «پی پی ام» از این گاز در محیط، سلامت انسان را تهدید می کند. لذا نشتی آن حتی به میزان کم از ناحیه لوله های انتقال دهنده و یا ظروف عملیاتی که بیشتر در واحدهای گوگردسازی واقع شده می تواند خطرهایی را برای سلامتی کارکنان داشته باشد. برای رفع آثار سوء زیست محیطی گاز ئیدروژن سولفوره آن را پس از تفکیک از گاز ترش به واحدهای گوگردسازی انتقال می دهند و در آن جا طی یک دوره انجام واکنش های شیمیایی به گوگرد تبدیل می شود. سپس گازهای باقیمانده وارد کوره ی زباله سوز شده تا در آن جا پس از اکسیده شدن به صورت گازهای کم خطر به محیط وارد شود. گازی است بسیار خطرناک با بوی تخم مرغ گندیده.
این گاز در غلظت کم باعث سردرد و تهوع و در غلظت 150PPM موجب ورم ملتحمه و سوزش غشاء بینی می شود. همچنین در غلظت 200PPM بوی آن به خوبی قابل تشخیص نیست. و باعث تحریک چشم و ریه می گردد. در غلظت 500PPM نیز چنانچه انسان برای 5 تا 30 دقیقه در معرض آن قرار گیرد اسهال و التهاب به وجود می آورد و تعادل فرد را مختل می سازد. این گاز به سرعت از میان حفره های غشاء ریه عبور می کند و وارد جریان خون می شود و به علت اشکالات تنفسی در غلظت 1000PPM سبب بیهوشی سریع می شود و در صورتی که خیلی سریع تنفس مصنوعی داده نشود، شخص می میرد.
این گاز سنگین تر از هوا است و حد مجاز آن در محیط های پالایشگاهی و صنعتی 10PPM است. مانند گاز طبیعی قابلیت انفجار دارد ولی مرز پایین انفجار آن 3.4% حجمی در هوا است.
دی اکسید گوگرد :
تحت شرایط متعارفی گازی بی رنگ است ولی در هوا تولید بخارات سفید می کند که بوی زننده و خفه کننده ای دارد و محرک سرفه است که در اثر اکسیداسیون آن مواد گوگرد دار تولید می شود و در آب و در حلال های آبی قطبی الک ها، آمیدها و اترها و در بازها (آمین ها) قابل حل بوده و تشکیل نمک هایی می دهد که بر حسب دما جانشین پذیرند و منظور نمک های تشکیل شده باشد دی اکسید گوگرد خود یکی از عوامل اصلی تشکیل دهنده ی باران های اسیدی است و در بدن مسمومیت ایجاد می کند.
یونانیان قدیم در حدود 1000 سال پیش از میلاد مسیح برای ضدعفونی کردن خانه های خود از دی اکسید گوگرد حاصل از سوختن گوگرد جامد استفاده می کردند. غفظت زیاد این ماده در هوای شهرهای بزرگ که ناشی از سوخت خودروهاست نه تنها در تغذیه ی گیاهان ایجاد مشکل می کند بلکه باعث سوختگی گیاهان و مسمومیت در گیاهان نیز می شود. بنابراین اثرات سمی آن (به خصوص در گیاهان) به مراتب بیشتر از دی اکسید نیتروژن است همچنین از محرک ترین مواد در تحریک سلول های مجاری تنفسی است.
دی اکسید گوگرد هم منشا طبیعی دارد و هم حاصل فعالیت های انسانی است (منشا مصنوعی دارد) این گاز در تروپوسفر به طور طبیعی برابر یکصدم تا دوصدم میلی گرم در هر متر مکعب هوا سات که با افزایش مصرف سوخت میزان آن بالا می رود. به طوری که در زمستان ها در کانون های شهری حتی به پنج دهم تا شش دهم میلی گرم در هر مترمکعب از هوا می رسد. معمولا 70 درصد از دی اکسیدگوگرد موجود در هوا بر اثر سوخت زغال در کارخانه های مولد برق تولید می شود. این کارخانه ها در هر سال 100 میلیون تن از این گاز را وارد هوا می کنند. آتشفشان ها نیز منبع مهمی در تولید دی اکسید گوگرد به شمار می آیند به طوری که در اثر فعالیت های آتشفشانی سالانه در حدود 2 میلیون تن از این گاز وارد اتمسفر می شود.
این گاز توسط موتورهای دیزلی و نیروگاه ها تولید می گردد. دی اکسید سولفور همراه دود عامل مرگ و میر بالا در موارد حاد آلودگی هوا، در شهرهای بزرگ و صنعت جهان است. اثر عمده این آلاینده ها بر ریه هاست. بدین ترتیب که راه های هوایی را تنگ می کند و تنفس را مشکل می سازد و یا تولید اسید به بافت های بینی، حلق حنجره و ریه آسیب می رساند. این عارضه در بیماران آسمی و کودکان آشکارتر است.
سولفید هیدروژن :
گازی با سمیت بالا است که به عنوان یک قارچ کش قوی به کار می رود. سولفید هیدروژن به صورت غیریونی برای آبزیان و به خصوص ماهیان سمی است که همچنین آنرا می توان در برنج یافت.
سولفیت ها :
سولفیت ها به وفور بعنوان آنتی اکسیدان و ضدمیکرب برای حفاظت غذاها و نوشابه ها بکار می روند. سولفور دی اکسید یک آلوده کننده هوا می باشد.
آنزیم سولفیت اکسیداز که یک آنزیم وابسته به مولیبدیوم است سولفیت را به سولفات تبدیل نموده و از اثرات سمی سولفیت جلوگیری می کند. بعضی از مردم بطور ژنتیکی فاقد این آنزیم هستند. علاوه بر این رژیم های غذایی با مولیبدیوم کم می تواند آنزیم سولفیت اکسیداز را غیر فعال نماید.
مطالعات نشان داده که سیاناید از طریق مهار سیتوکروم اکسیداز و در نتیجه غیر فعال کردن سولفیت اکسیداز سمیت سولفیت را در سلول های ایزوله ی کبد افزایش می دهد. مهارکننده های سیتوکروم P-450 مثل متیراپون و پیپرونیل بوتوکساید اثرات حفاظتی بر علیه سمیت سولفیت دارند GSSG بلافاصله پس از افزودن سولفیت به هپاتوسیت ها در حضور یا عدم حضور سیاناید ناپدید گردید. GSH- نیز بطور کامل طی 2 ساعت انکوباسیون سلول ها با سولفیت ناپدید گردید. این پدیده بیانگو واکنش سولفیت یا متابولیت های رادیکالی آن با پیوندهای دی سولفیدی GSSG و پروتئین ها می باشد. افزایش در تیوتریتول که یک احیاء کننده تیول ها می باشد. حتی یک ساعت پس از افزودن سولفیت به سلول ها باعث برگشت GSH و جلوگیری از مرگ سلول گردید که بیانگر دخالت اکسیداتیو استرس در سمیت سولفیت می باشد. دفروکسامین و آنتی اکسیدان ها نیز اثر محافظتی داشتند که از نظریه ی دخاتل رادیکال های آزاد در مکانیسم سمیت سولفیت حمایت می نمایند.
دی سولفید کربن :
مایعی است بی رنگ و روشن با بوی شیرین شبیه اتر است ولی محصول صنعتی آن بوی زننده ای دارد. موارد استفاده دی سولفید کربن متنوع بوده و می توان به برخی از مهمترین آن ها اشاره نمود:
این ماده حلال مهم سلولز قلیایی، چربی ها، روغن ها، صمغ ها، موم ها می باشد. به علاوه در تولید ابریشم مصنوعی، در ساخت شیشه عینک و به عنوان حشره کش و در استخراج روغن مورد استفاده قرار می گیرد.
این ماده در مرحله اول روی دستگاه اعصاب مرکزی و محیطی اثر می گذارد.
در ابتدا سردرد و احساس ناخوشایند رخ می دهد سپس سرگیجه، کرخی اندام ها، نامنظم شدن تنفس و مرگ رخ می دهد. در مسمومیت مزمن، ضعف، خستگی، سردرد، آشفتگی خواب، اغلب همراه با خواب های ترسناک، کرخی اندام ها، از بین رفتن اشتها و درد معده مشاهده می شود.
تماس مزمن با این ماده باعث بالا رفتن چربی های خون می شود.
این ماده از راه پوست هم جذب می شود. لیکن راه اصلی جذب آن تنفس است.
بهترین و موثرترین اقدام پیشگیرانه به کار بردن حلال های دیگر به جای این ماده است ولی اگر مجبور به استفاده از آن هستیم می بایستی تهویه موضعی خوبی برقرار کنیم. کارگرانی که از ناراحتی های عصبی، کلیوی و کبدی داشته باشند باید هنگام کار با این ماده به خوبی از خطرات آن با اطلاع شوند.
سولفور آهن :
که به عنوان یک ماده آتش زا شناخته می شود، بیشتر در جداره فلزی ظروف پالایشگاهی و خطوط انتقال گازی تشکیل می شود که در معرض دائمی گازهای H2S همراه با گاز ترش قرار دارند.
سولفور یا گوگرد ( S )

گوگرد یکی از عناصر شیمیایی جدول تناوبی است که نماد آن S و عدد اتمی آن 16 میباشد. گوگرد یک نافلز فراوان بیبو، بیمزه و چند ظرفیتی است که دارای اثر قلیایی بوده و بیشتر به شکل کریستال های زرد رنگ که در کانیهای سولفید و سولفات بدست میآید شناخته شده است.
گوگرد یک عنصر حیاتی و لازم برای تمامی موجودات زنده می باشد که مورد نیاز اسیدآمینهها و پروتئینها هم است. این عنصر به صورت اولیه در کودها استفاده میشود ولی بصورت گسترده تر در باروت، ملین ها، کبریت ها و حشره کش ها بکار گرفته میشود.
نام گوگرد از واژه لاتین Sulphur گرفته شده است. این عنصر تنها شبه فلزی است که از دیرباز به دلیل شکل طبیعی آن شناخته شده و آن را در زبان انگلیسی بریم استون (Brimstone) می نامیدند. بعلاوه گوگرد طبیعی را در گذشته کبریت می نامیدند.
گوگرد سیزدهمین عنصر فراوان در پوسته زمین است که در حدود 0.052% پوسته زمین را می سازد. همچنین گوگرد عنصری غیرفلزی از گروه ششم جدول تناوبی است که از نظر شیمیایی بسیار فعال است.
خصوصیات قابل توجه : ظاهر این نافلز به رنگ زرد کمرنگ می باشد که بسیار سبک و نرم است. این عنصر به هنگام ترکیب با هیدروژن بوی مشخصی دارد که مشابه بوی تخم مرغ فاسد شده می باشد. گوگرد با شعله آبی رنگ می سوزد و بوی عجیبی از خود ساتع می کند. گوگرد در آب حل شدنی نیست ولی در دی سولفیدکربن حل می شود.
کاربردها : این عنصر برای استفاده های صنعتی مانند تولید (H2SO4)اسیر سولفوریک برای باطریها، تولید باروت و حرارت دادن لاستیک تولید می شود. گوگرد در فرایند تولید کودهای فسفاتی به عنوان ماده ضدقارچ عمل می کند. سولفاتها در کاغذهای شستشو و خشکبار نیز کاربرد دارند. همچنین گوگرد در ساخت کبریت و آتش بازی نیز بکار گرفته می شود. تیوسولفات آمونیوم یا سدیم به عنوان عامل ثابت کننده در عکاسی کاربرد دارد. سولفات منیزیم می تواند به عنوان ماده ضد خشکی و ملین که یک مکمل منیزیم گیاهی است به کار گرفته شود.
نقش بیولوژیکی : آمینواسیدهای Cysteine, Methionine, Homocysteine و همچنین برخی از آنزیم ها حاوی گوگرد می باشند که در واقع گوگرد را به یک عنصر حیاتی برای سلول های زنده تبدیل کرده اند. ترکیبات دی سولفیدی مابین polypeptide ها در ساختار پروتئینی بسیار مهم می باشند. برخی از گونه های باکتری ها هم از سولفید هیدروژن بجای آب در فرایند فتوسنتز خود استفاده می کنند.
گوگرد توسط گیاهان بصورت ین سولفات از خاک جذب می شود و همچنین در حالت سولفید هگزافلوراید به صورت یک گاز گلخانه ای عمل می کند گوگرد یک قارچ کش و حشره کش و میکروب کش قوی است که در برخی از کارخانه جات صنعتی به عنوان حشره کش و قارچ کش و حتی میکروب کش تولید می شود. بنابراین می تواند علاوه بر آفات حشرات و قارچ ها و میکروب های مفید را هم از بین ببرد. وجود 4/1 الی 7/1 میلی گرم گوگرد در هر لیتر از هوا به فاصله نیم ساعت الی یک ساعت کشنده است.
خطرات : گوگرد در مسمومیت های حاد سبب خفگی و کبود شدن انگشتان و لب ها می شود که در این حالت بیمار نمی تواند حرف بزند و در عمل بلع مشکل دارد اما مرگ آنی ناشی از گوگرد کمتر مشاهده شده است. بیشترین حجم آلودگی هوا از گوگرد و ترکیبات آن به طور مصنوعی حاصل از فعالیت انسان ها و با سوختن زغال سنگ و نفت و علی الخصوص نفت خام ایجاد می شود.
تنفس گوگرد و پودرهای گوگردی آثار منفی تنفسی از جمله سرفه های شدید و تنگی نفس را به دنبال دارد. روند به طوری که کلا روند ورود پودرهای سولفاتی به صورت خشک به داخل ریه مکانیزم دفاعی ریه را برای دفع برخی از اجسام بزرگتر از کار می اندازد و سبب این بیماری ها می شود.
گاز طبیعی هم حاوی مقداری گوگرد یا ترکیباتی از آن است که باعث خورندگی لوله های فلزی حاوی گاز شهری می شوند که خود یکی از مهم ترین مشکلات ناشی از وجود گوگرد در گاز طبیعی شهری است.

1. خاک 2. رنگ ساختمان ها 3. آب های سطحی و آبزیان 4. گیاهان و درختان 5. آثار تاریخی 6. پوست بدن (به صورت بیماری های پوستی) و 7. دستگاه تنفسی برجای می گذارد.
گوگرد از عناصر پرمقدار مصرفی روزانه در مقیاس گرم می باشد که غالبا به صورت املاح همراه با مواد غذایی وارد دستگاه گوارش می شود و پس از ورود به گردش خون و گذر از منافذ نسبتا گشاد مویرگی وارد آب بین سلولی می شوند و در مجاورت سلول ها قرار می گیرند. این مواد معدنی در آب به صورت یون درمی آیند.
بدن انسان در حدود 0.4% گوگرد دارد. قسمتی از پروتئین ها، آمینواسیدها، مخمرها، هرمون ها، ویتامین ها و انسولین را تشکیل می دهد و برای ساخت بخش های زنده و ایجاد تحول در موجودات، خیلی مهم می باشد و بیش از همه جا در پروتئین های مو و شاخ حیوانات موجود می باشد. در بافت عصبی، غضروف، استخوان و زردآب وجود دارد. وقتی مقدار گوگرد در بدن کم شود استخوان ها شکننده می شود و مو می ریزد. گوگرد از اهمیتی ویژه در غذاها برخوردار است. نخود، عدس، جو صحرایی و تخم مرغ دارای مقادیری گوگرد می باشند. در گندم به علت کمبود گوگرد کاهش کیفیت جدی تر از کاهش عملکرد است. زیرا در اثر کمبود شدید گوگرد در غذا با کاهش جدی گوگرد در آمینواسید پروتیمیس مواجه می شویم. گوگرد در ساختمان سه اسیدآمینه شرکت می کند. (اتصال آمینه اسیدها به همدیگر باعث تشکیل پروتئین می شود) تقریبا 25% از وزن بدن از گوگرد تشکیل شده است.
بیشترین غلظت این ماده در کراتین (که به موها، ناخن و پوست ما استحکام می دهد) موجود است. این ماده به نام «ماده معدنی زیبای طبیعی» خوانده می شود. زیرا بدن ما برای تهیه «گلاژن» (که باعث حالت ارتجاعی پوست و ظاهر جوانمان می شود) نیاز به گوگرد دارد.
ترکیبات: از ترکیبات مهم گوگردی اکسیدهای گوگردی هستند که در پالایشگاه ها تولید شده و از مهم ترین عوامل آلوده کننده هوا هستند. سایر ترکیبات گوگردی شامل گاز H2S که بسیار خطرناک و کشنده است، کربونیل سولفید و کربن دی سولفید که در واحدهای پالایشگاهی و تاسیسات جنبی آن ایجاد می شود هستند.
گاز سولفور دی اکسید:
که بیشتر در اثر سوخت های فسیلی مثل ذغال سنگ مصرفی نیروگاه های حرارتی و پالایشگاه ها از راه سوختن گازهای زاید مشعل اصلی در کارخانه های تولید اسیدسولفوریک و کود شیمیایی و همچنین توسط اتوموبیل ها تولید می شود. و یکی از آلوده کننده های عمده هوا است. این گاز در قسمت فوقانی دستگاه تنفسی جذب شده و باعث تورم، تحریک و ترشح مخاط می شود. اگر غلظت گاز SO2 یک «پی پی ام» باشد سبب انقباض مجرای تنفسی می شود و در افراد آسمی یا دارای تنگی نفس حتی در غلظت های 5.0 تا 25.0 PPM باعث ناراحتی ریوی می گردد. در هوای مرطوب گاز SO2 به اسید سولفوریک تبدیل می شود و خطر سوزش آوری و تحریک کنندگی آن به مراتب افزایش می یابد. این گاز برای گیاهان نیز زیان آور است. و بنابراین حد مجاز آن برای گیاهان خیلی کمتر از انسان و جانوران است. گاز SO2 در غلظت 20PPM در محیط باعث سرفه و اشک چشم می گردد و در غلظت 30PPM جدای از اشک ریزی شدید چشم بوی آن بسیار ناخوشایند است. این گاز در غلظت های 100~200PPM در هوا سلامتی انسان را به خطر می اندازد. ولی در غلظت های 600~800PPM پس از چند دقیقه سبب مرگ می شود.
کاربردهای دی اکسید گوگرد:
1- دی اکسید گوگرد به عنوان ماده سردکننده مثلا به عنوان گاز یخچال ها در گذشته مورد استفاده قرار می گرفت.
2- به عنوان ضدعفونی کننده.
3- به عنوان رنگ بر در تکنولوژی مواد غذایی
4- در صنایع نساجی و کاغذسازی برای تهیه H2SO3 و H2SO3 و NaHSO3 2
ئیدروژن سولفوره:
گاز ئیدروژن سولفوره که به مقدار کم و به عنوان یک ماده سمی و ناخواسته همراه گاز ترش به پالایشگاه ها وارد می شود، طی یک عملیات خاص و با استفاده از آمین در واحدهای پالایش از گاز ترش جدا می گردد. وجود مقادیر جزیی در حد یک هزار «پی پی ام» از این گاز در محیط، سلامت انسان را تهدید می کند. لذا نشتی آن حتی به میزان کم از ناحیه لوله های انتقال دهنده و یا ظروف عملیاتی که بیشتر در واحدهای گوگردسازی واقع شده می تواند خطرهایی را برای سلامتی کارکنان داشته باشد. برای رفع آثار سوء زیست محیطی گاز ئیدروژن سولفوره آن را پس از تفکیک از گاز ترش به واحدهای گوگردسازی انتقال می دهند و در آن جا طی یک دوره انجام واکنش های شیمیایی به گوگرد تبدیل می شود. سپس گازهای باقیمانده وارد کوره ی زباله سوز شده تا در آن جا پس از اکسیده شدن به صورت گازهای کم خطر به محیط وارد شود. گازی است بسیار خطرناک با بوی تخم مرغ گندیده.
این گاز در غلظت کم باعث سردرد و تهوع و در غلظت 150PPM موجب ورم ملتحمه و سوزش غشاء بینی می شود. همچنین در غلظت 200PPM بوی آن به خوبی قابل تشخیص نیست. و باعث تحریک چشم و ریه می گردد. در غلظت 500PPM نیز چنانچه انسان برای 5 تا 30 دقیقه در معرض آن قرار گیرد اسهال و التهاب به وجود می آورد و تعادل فرد را مختل می سازد. این گاز به سرعت از میان حفره های غشاء ریه عبور می کند و وارد جریان خون می شود و به علت اشکالات تنفسی در غلظت 1000PPM سبب بیهوشی سریع می شود و در صورتی که خیلی سریع تنفس مصنوعی داده نشود، شخص می میرد.
این گاز سنگین تر از هوا است و حد مجاز آن در محیط های پالایشگاهی و صنعتی 10PPM است. مانند گاز طبیعی قابلیت انفجار دارد ولی مرز پایین انفجار آن 3.4% حجمی در هوا است.
دی اکسید گوگرد :
تحت شرایط متعارفی گازی بی رنگ است ولی در هوا تولید بخارات سفید می کند که بوی زننده و خفه کننده ای دارد و محرک سرفه است که در اثر اکسیداسیون آن مواد گوگرد دار تولید می شود و در آب و در حلال های آبی قطبی الک ها، آمیدها و اترها و در بازها (آمین ها) قابل حل بوده و تشکیل نمک هایی می دهد که بر حسب دما جانشین پذیرند و منظور نمک های تشکیل شده باشد دی اکسید گوگرد خود یکی از عوامل اصلی تشکیل دهنده ی باران های اسیدی است و در بدن مسمومیت ایجاد می کند.
یونانیان قدیم در حدود 1000 سال پیش از میلاد مسیح برای ضدعفونی کردن خانه های خود از دی اکسید گوگرد حاصل از سوختن گوگرد جامد استفاده می کردند. غفظت زیاد این ماده در هوای شهرهای بزرگ که ناشی از سوخت خودروهاست نه تنها در تغذیه ی گیاهان ایجاد مشکل می کند بلکه باعث سوختگی گیاهان و مسمومیت در گیاهان نیز می شود. بنابراین اثرات سمی آن (به خصوص در گیاهان) به مراتب بیشتر از دی اکسید نیتروژن است همچنین از محرک ترین مواد در تحریک سلول های مجاری تنفسی است.
دی اکسید گوگرد هم منشا طبیعی دارد و هم حاصل فعالیت های انسانی است (منشا مصنوعی دارد) این گاز در تروپوسفر به طور طبیعی برابر یکصدم تا دوصدم میلی گرم در هر متر مکعب هوا سات که با افزایش مصرف سوخت میزان آن بالا می رود. به طوری که در زمستان ها در کانون های شهری حتی به پنج دهم تا شش دهم میلی گرم در هر مترمکعب از هوا می رسد. معمولا 70 درصد از دی اکسیدگوگرد موجود در هوا بر اثر سوخت زغال در کارخانه های مولد برق تولید می شود. این کارخانه ها در هر سال 100 میلیون تن از این گاز را وارد هوا می کنند. آتشفشان ها نیز منبع مهمی در تولید دی اکسید گوگرد به شمار می آیند به طوری که در اثر فعالیت های آتشفشانی سالانه در حدود 2 میلیون تن از این گاز وارد اتمسفر می شود.
این گاز توسط موتورهای دیزلی و نیروگاه ها تولید می گردد. دی اکسید سولفور همراه دود عامل مرگ و میر بالا در موارد حاد آلودگی هوا، در شهرهای بزرگ و صنعت جهان است. اثر عمده این آلاینده ها بر ریه هاست. بدین ترتیب که راه های هوایی را تنگ می کند و تنفس را مشکل می سازد و یا تولید اسید به بافت های بینی، حلق حنجره و ریه آسیب می رساند. این عارضه در بیماران آسمی و کودکان آشکارتر است.
سولفید هیدروژن :
گازی با سمیت بالا است که به عنوان یک قارچ کش قوی به کار می رود. سولفید هیدروژن به صورت غیریونی برای آبزیان و به خصوص ماهیان سمی است که همچنین آنرا می توان در برنج یافت.
سولفیت ها :
سولفیت ها به وفور بعنوان آنتی اکسیدان و ضدمیکرب برای حفاظت غذاها و نوشابه ها بکار می روند. سولفور دی اکسید یک آلوده کننده هوا می باشد.
آنزیم سولفیت اکسیداز که یک آنزیم وابسته به مولیبدیوم است سولفیت را به سولفات تبدیل نموده و از اثرات سمی سولفیت جلوگیری می کند. بعضی از مردم بطور ژنتیکی فاقد این آنزیم هستند. علاوه بر این رژیم های غذایی با مولیبدیوم کم می تواند آنزیم سولفیت اکسیداز را غیر فعال نماید.
مطالعات نشان داده که سیاناید از طریق مهار سیتوکروم اکسیداز و در نتیجه غیر فعال کردن سولفیت اکسیداز سمیت سولفیت را در سلول های ایزوله ی کبد افزایش می دهد. مهارکننده های سیتوکروم P-450 مثل متیراپون و پیپرونیل بوتوکساید اثرات حفاظتی بر علیه سمیت سولفیت دارند GSSG بلافاصله پس از افزودن سولفیت به هپاتوسیت ها در حضور یا عدم حضور سیاناید ناپدید گردید. GSH- نیز بطور کامل طی 2 ساعت انکوباسیون سلول ها با سولفیت ناپدید گردید. این پدیده بیانگو واکنش سولفیت یا متابولیت های رادیکالی آن با پیوندهای دی سولفیدی GSSG و پروتئین ها می باشد. افزایش در تیوتریتول که یک احیاء کننده تیول ها می باشد. حتی یک ساعت پس از افزودن سولفیت به سلول ها باعث برگشت GSH و جلوگیری از مرگ سلول گردید که بیانگر دخالت اکسیداتیو استرس در سمیت سولفیت می باشد. دفروکسامین و آنتی اکسیدان ها نیز اثر محافظتی داشتند که از نظریه ی دخاتل رادیکال های آزاد در مکانیسم سمیت سولفیت حمایت می نمایند.
دی سولفید کربن :
مایعی است بی رنگ و روشن با بوی شیرین شبیه اتر است ولی محصول صنعتی آن بوی زننده ای دارد. موارد استفاده دی سولفید کربن متنوع بوده و می توان به برخی از مهمترین آن ها اشاره نمود:
این ماده حلال مهم سلولز قلیایی، چربی ها، روغن ها، صمغ ها، موم ها می باشد. به علاوه در تولید ابریشم مصنوعی، در ساخت شیشه عینک و به عنوان حشره کش و در استخراج روغن مورد استفاده قرار می گیرد.
این ماده در مرحله اول روی دستگاه اعصاب مرکزی و محیطی اثر می گذارد.
در ابتدا سردرد و احساس ناخوشایند رخ می دهد سپس سرگیجه، کرخی اندام ها، نامنظم شدن تنفس و مرگ رخ می دهد. در مسمومیت مزمن، ضعف، خستگی، سردرد، آشفتگی خواب، اغلب همراه با خواب های ترسناک، کرخی اندام ها، از بین رفتن اشتها و درد معده مشاهده می شود.
تماس مزمن با این ماده باعث بالا رفتن چربی های خون می شود.
این ماده از راه پوست هم جذب می شود. لیکن راه اصلی جذب آن تنفس است.
بهترین و موثرترین اقدام پیشگیرانه به کار بردن حلال های دیگر به جای این ماده است ولی اگر مجبور به استفاده از آن هستیم می بایستی تهویه موضعی خوبی برقرار کنیم. کارگرانی که از ناراحتی های عصبی، کلیوی و کبدی داشته باشند باید هنگام کار با این ماده به خوبی از خطرات آن با اطلاع شوند.
سولفور آهن :
که به عنوان یک ماده آتش زا شناخته می شود، بیشتر در جداره فلزی ظروف پالایشگاهی و خطوط انتقال گازی تشکیل می شود که در معرض دائمی گازهای H2S همراه با گاز ترش قرار دارند.
fa7alveh
کاربر ممتاز تالار شیمی
..::آزبست یا پنبه کوهی::..
..::آزبست یا پنبه کوهی::..

آزبست از جمله مواد خطرناکی است که هنوز هم در بسیاری از کشورها استفاده می شود. برای اولین بار یکی از شاگردان ارسطو بود که در کتاب خود با عنوان درباره سنگ ها به ماده ای بدون نامی که شبیه تئوفراستوس، چوب پوسیده اشاره کرد که در اختلال با نفت می سوزد، بدون آنکه آسیبی ببیند.
در 300 سال قبل از میلاد بعدها این ماده آزبست نام گرفت. در ساختمان آزبست پنبه کوهی یا پنبه نسوز عناصری مانند سلیس، منزیم و آهن وجود دارند. در طبیعت به رنگ سفید، قهوه ای و آبی به چشم می خورد.
در سال 1820 یک دانشمند ایتالیایی برای اولین بار ضدآتش را با استفاده از الیاف آزبست تولید کرد. در اوایل قرن 20 یک مهندس اتریشی به نام لودویک هاچک از ترکیب الیاف این ماده با سیمان موفق به اختراع سیمان نسوز شود که با استقبال جهانی روبرو شد.
آزبست يا پنبه كوهي:
آزبست واژهاي است كلي كه براي تمام كانيهاي سيليكاته با خاصيت جدا شدن به صورت رشته هاي قابل انعطاف به كار مي رود. به علت داشتن ويژگيهاي نسوز بودن و قابليت انعطاف به صورت يك ماده صنعتي با ارزش در آمده است.
مهمترین محصولات آزبستی :
1- سیمانی (لوله آزبست سیمانی و ناودانی و صفحات ایرانت)
2- جامه نسوز
3- کاغذ آزبستی (پوشش عایق ها و لوله های الکتریکی)
4- مواد مالشی و حرارتی (صفحه کلاچ – لنت ترمز – انواع واشرها)
5- ماده پرکننده (در آسفالت – رنگ شیمیایی – کاشی – پلاستیک)

آزبست ها را مي توان به دو گروه عمده سرپانتين و آمفيبول تقسيم كرد.
كريزوتيل كه يك هيدروسيليكات منيزيم با فرمول شيميايي Mg3Si2 O5 (OH)4 است.
نوعي آزبست سرپانتين و با ارزش ترين نوع مي باشد كه تمام آزبست هاي تجاري از آن مشتق مي گردند، رشته هاي محكم و ابريشمي كريزوتيل به آساني ريسيده شده و تا حرارت 275 درجه سانتيگراد را تحمل مي كنند گسترش آنها بيشتر در سرپانتين كه نوعي سنگ حاصل از تجزيه سنگهاي فوق قليايي نظير پريدوتيت تحت شرايط دگرگوني درجه پايين و متوسط مي باشد بنظر مي رسد.
سرپانتين از تجزيه شدن اليوين توسط محلولهاي گرم حاصل از سرد شدن ماگما كه از نظر شيميايي نيز فعال هستند به وجود آمده باشد. كريزوتيلها رگه هايي از رشته ها را داخل سرپانتين ايجاد مي كنند كه ممكن است 20% سنگ را در بر گيرد. حداقل پنج نوع آزبست آمفيبولي شناخته شده اند. ولي كرسيدوليت كه يك آمفيبول آهن سديم دار با فرمول شيميايي Na2 ( Fe3+ )2 ( Fe2+ )3 Si8 O22 (OH)2 مي باشد. معموليترين نوع آن و بيشتر به نام آزبست آبي يا پنبه كوهي آبي معروف است.
كرسيدوليت كه رشته هاي ضخيم و طويلي است نسبت به كريزوتيل استحكام بيشتر و دوام كمتري دارد. همچنين مقاومت آن در برابر حرارت كمتر مي باشد. ساير انواع آزبست آمفيبولي كاربرد كمتري دارند و مهمترين كاربردشان در تهيه مواد عايق است. كرسيدوليت كه بيشتر در سنگهاي دگرگوني نظير اسليت و شيست يافت مي شود بنظر مي رسد از دگرگوني ساير كانيها تحت دما وفشار بالاي محيطي، حاصل از عمق تدفين به وجود مي آيد. عليرغم كاربرد گسترده آزبست، دفتر حفاظت از محيط فدرال (EPA) منعي تدريجي را براي توليدات جديد آزبستي قرار داد و اين ممنوعيت اعمال گرديد. زيرا برخي از فرمهاي آزبست چنانچه توسط استنشاق وارد ريه ها شوند مي توانند به آن آسيب رسانده و منجر به سرطان ريه شوند. كريزوتيل كه رشته هاي مجعدي هستند در ريه ها جاي گيري نمي كنند بعلاوه رشته هاي آن معمولا در بافتها محلول و ناپديد مي شوند. در مقابل كرسيدوليت كه رشته هاي نازك و صافي هستند به ريه ها وارد شده و آنجا باقي مي مانند. اين رشته ها به بافت ريه آسيب رسانده و در دراز مدت منجر به سرطان ريه مي گردد. بنابراين آزبست هايي كه باعث سرطان ريه مي شود مربوط به كرسيدوليت هستند نه كريزوتيل.
معادن آزبست در ایران غالبا در سنگ های افیولیت یافت شده است.
آزبستوز شرح بیماری:
آزبستوز عبارت است از التهاب ریه ها به لعت استنشاق ذرات آزبست. این یک اختلال مزمن است اما مسری نیست. آزبستوز ممکن است منجر به سرطان ریه شود (خطر بروز با سیگار کشیدن بسیار بیشتر می شود). مردان بالای 40 سالی که در معرض ذرات آزبست بوده اند با احتمال بیشتری دچار این بیماری می شوند. آزبستوز شاید مهمترین بیماری ریوی ناشی از کار باشد.

علایم شایع:
علائم باليني:
شروع بيماري علامت دار قبل از حداقل 20 سال مواجهه شايع نمي باشد. اما گزارش هايي بعد از 3 سال تماس داشته ايم. شايع ترين علامت، تنگي نفس در حين فعاليت و سرفه بدون خلط تحريکي است. صداهاي ريه در حين گوش کردن با گوشي کاملاً تغيير نشان مي دهد. درد قفسه سينه بصورت شايع وجود دارد.
علایم اولیه:
تنگی نفس، سرفه ای که یا بدون خلط است یا خلط کمی دارد، احساس کسالت عمومی.
علایم بعدی:
نامنظمی خواب، بی اشتهایی، درد قفسه سینه، خشونت صدا، سرفه خونی، علایم نارسایی احتقانی قلب، آبی شدن ناخن ها.
علل:
مواجهه طولانی مدت با ذرات ریز آزبست به هنگام کار یا از منابع دیگر. قسمت محیطی ریه ها در اثر فیبرهای آزبست دچار آزردگی می شوند، که نهایتا التهاب، ضخیم شدگی و تشکیل بافت جوشگاهی در بافت ریوی (فیبروز ریوی) را به دنبال خواهد داشت.
عوامل افزایش دهنده خطر :
مشاغلی که در ارتباط با آزبست هستند، تغذیه نامناسب، سیگار کشیدن، سوء در مصرف الکل پیشگیری به هنگام قرار گرفتن در معرض آزبست، از ماسک حفاظتی مناسب یا هودی که با هوای آزاد ارتباط دارد استفاده کنید، اقدامات توصیه شده در رابطه با مهار غبارهای آزبست را به کار بندید، سیگار نکشید. یک برنامه منظم ورزشی داشته باشید تا سلامت قلبی – تنفسی شما حفظ شود.
برای کارگرانی که در صنایع آزبست کار می کنند باید به طور منظم عکس برداری با اشعه ایکس انجام شود تا هرگونه سایه غیرطبیعی در ریه ها شناسایی شود. اگر در عکس مشکلی بود، فرد باید کار با آزبست را رها کند حتی اگر علامتی وجود نداشته باشد. عواقب مورد انتظار این بیماری در حال حاضر غیرقابل علاج است. اما علایم را می توان تخفیف داد یا تحت کنترل درآورد، تحقیقات علمی درباره علل و درمان این بیماری ادامه دارد. بنابراین امید می رود درمان ها روز به روز موثری ابداع شوند و نهایتا بتوان این بیماری را معالجه نمود.
عوارض احتمالی :
بیماری سل، نارسایی قلبی به علت بیماری ریوی، روی هم خوابیدن بافت ریوی، جمع شدن مایع در فضای جنب (اطراف ریه ها) درمان اصول کلی: سیگار کشیدن را متوقف کنید، در صورت بروز هرگونه عفونت تنفسی، حتی سرماخوردگی، به پزشک مراجعه کنید، اگر بیماری پیشرفته باشد، به فکر نقل مکان به یک جای گرم و خشک باشید، فیزیوتراپی تنفسی و یادگیری روش های آن روش های تخلیه نایژه ای را فرا گیرید و به کار بندید، از دستگاه بخور خنک برای نرم کردن ترشحات نایژه ای استفاده کنید تا این ترشحات راحت تر تخلیه شوند، واکسیناسیون آنفلوانزا و پنوموکک (ذات الریه) را به روز نگاه دارید، از افرادی که دچار عفونت هستند دوری کنید. داروها آنتی بیوتیک برای عفونت، گشادکننده نایژه (استنشاقی یا خوراکی) همراه با استنشاق درمانی برای باز کردن لوله های نایژه ای تا حداکثر ممکن برای رفع ناراحتی خفیف می توان از داروهایی مثل استامینوفن استفاده نمود، امکان دارد اکسیژن ضروری شود. فعالیت در زمان ابتلا به این بیماری در صورت وجود عفونت، در رختخواب استراحت کنید، پس از آغاز درمان، با رو به بهبود گذاشتن علایم فعالیت در زمان ابتلا به این بیماری های عادی خود را از سر گیرید، برای حفظ ظرفیت ریه باید ورزش منظم به هر شکلی که قابل تحمل باشد انجام داد. رژیم غذایی رژیم خاصی توصیه نمی شود.
در گذشته تمامي افراد بيمار مبتلا به اين حالت، قبل از 30 سالگي مي مردند. اميد به زندگي در اين بيماران همچنان کمتر از افراد عادي است. اينها در20 تا 40 درصد موارد،بيماريشان پيشرفت خواهد کرد. اصل مهم در پيشگيري، کنترل گرد وغبار است. پاشيدن آزبست به منظور عايق کاري در هنگام ساخت ساختمان ها و بناها بايد منع شود. در دفع ضايعات کارخانجاتي که آزبست مصرف مي کنند،رعايت اصول ايمني و اقدامات پيشگيرانه جهت جلوگيري از آلودگي محيط زيست ضروري است.
..::آزبست یا پنبه کوهی::..

آزبست از جمله مواد خطرناکی است که هنوز هم در بسیاری از کشورها استفاده می شود. برای اولین بار یکی از شاگردان ارسطو بود که در کتاب خود با عنوان درباره سنگ ها به ماده ای بدون نامی که شبیه تئوفراستوس، چوب پوسیده اشاره کرد که در اختلال با نفت می سوزد، بدون آنکه آسیبی ببیند.
در 300 سال قبل از میلاد بعدها این ماده آزبست نام گرفت. در ساختمان آزبست پنبه کوهی یا پنبه نسوز عناصری مانند سلیس، منزیم و آهن وجود دارند. در طبیعت به رنگ سفید، قهوه ای و آبی به چشم می خورد.
در سال 1820 یک دانشمند ایتالیایی برای اولین بار ضدآتش را با استفاده از الیاف آزبست تولید کرد. در اوایل قرن 20 یک مهندس اتریشی به نام لودویک هاچک از ترکیب الیاف این ماده با سیمان موفق به اختراع سیمان نسوز شود که با استقبال جهانی روبرو شد.
آزبست يا پنبه كوهي:
آزبست واژهاي است كلي كه براي تمام كانيهاي سيليكاته با خاصيت جدا شدن به صورت رشته هاي قابل انعطاف به كار مي رود. به علت داشتن ويژگيهاي نسوز بودن و قابليت انعطاف به صورت يك ماده صنعتي با ارزش در آمده است.
مهمترین محصولات آزبستی :
1- سیمانی (لوله آزبست سیمانی و ناودانی و صفحات ایرانت)
2- جامه نسوز
3- کاغذ آزبستی (پوشش عایق ها و لوله های الکتریکی)
4- مواد مالشی و حرارتی (صفحه کلاچ – لنت ترمز – انواع واشرها)
5- ماده پرکننده (در آسفالت – رنگ شیمیایی – کاشی – پلاستیک)

كريزوتيل كه يك هيدروسيليكات منيزيم با فرمول شيميايي Mg3Si2 O5 (OH)4 است.
نوعي آزبست سرپانتين و با ارزش ترين نوع مي باشد كه تمام آزبست هاي تجاري از آن مشتق مي گردند، رشته هاي محكم و ابريشمي كريزوتيل به آساني ريسيده شده و تا حرارت 275 درجه سانتيگراد را تحمل مي كنند گسترش آنها بيشتر در سرپانتين كه نوعي سنگ حاصل از تجزيه سنگهاي فوق قليايي نظير پريدوتيت تحت شرايط دگرگوني درجه پايين و متوسط مي باشد بنظر مي رسد.
سرپانتين از تجزيه شدن اليوين توسط محلولهاي گرم حاصل از سرد شدن ماگما كه از نظر شيميايي نيز فعال هستند به وجود آمده باشد. كريزوتيلها رگه هايي از رشته ها را داخل سرپانتين ايجاد مي كنند كه ممكن است 20% سنگ را در بر گيرد. حداقل پنج نوع آزبست آمفيبولي شناخته شده اند. ولي كرسيدوليت كه يك آمفيبول آهن سديم دار با فرمول شيميايي Na2 ( Fe3+ )2 ( Fe2+ )3 Si8 O22 (OH)2 مي باشد. معموليترين نوع آن و بيشتر به نام آزبست آبي يا پنبه كوهي آبي معروف است.
كرسيدوليت كه رشته هاي ضخيم و طويلي است نسبت به كريزوتيل استحكام بيشتر و دوام كمتري دارد. همچنين مقاومت آن در برابر حرارت كمتر مي باشد. ساير انواع آزبست آمفيبولي كاربرد كمتري دارند و مهمترين كاربردشان در تهيه مواد عايق است. كرسيدوليت كه بيشتر در سنگهاي دگرگوني نظير اسليت و شيست يافت مي شود بنظر مي رسد از دگرگوني ساير كانيها تحت دما وفشار بالاي محيطي، حاصل از عمق تدفين به وجود مي آيد. عليرغم كاربرد گسترده آزبست، دفتر حفاظت از محيط فدرال (EPA) منعي تدريجي را براي توليدات جديد آزبستي قرار داد و اين ممنوعيت اعمال گرديد. زيرا برخي از فرمهاي آزبست چنانچه توسط استنشاق وارد ريه ها شوند مي توانند به آن آسيب رسانده و منجر به سرطان ريه شوند. كريزوتيل كه رشته هاي مجعدي هستند در ريه ها جاي گيري نمي كنند بعلاوه رشته هاي آن معمولا در بافتها محلول و ناپديد مي شوند. در مقابل كرسيدوليت كه رشته هاي نازك و صافي هستند به ريه ها وارد شده و آنجا باقي مي مانند. اين رشته ها به بافت ريه آسيب رسانده و در دراز مدت منجر به سرطان ريه مي گردد. بنابراين آزبست هايي كه باعث سرطان ريه مي شود مربوط به كرسيدوليت هستند نه كريزوتيل.
معادن آزبست در ایران غالبا در سنگ های افیولیت یافت شده است.
آزبستوز شرح بیماری:
آزبستوز عبارت است از التهاب ریه ها به لعت استنشاق ذرات آزبست. این یک اختلال مزمن است اما مسری نیست. آزبستوز ممکن است منجر به سرطان ریه شود (خطر بروز با سیگار کشیدن بسیار بیشتر می شود). مردان بالای 40 سالی که در معرض ذرات آزبست بوده اند با احتمال بیشتری دچار این بیماری می شوند. آزبستوز شاید مهمترین بیماری ریوی ناشی از کار باشد.

علایم شایع:
علائم باليني:
شروع بيماري علامت دار قبل از حداقل 20 سال مواجهه شايع نمي باشد. اما گزارش هايي بعد از 3 سال تماس داشته ايم. شايع ترين علامت، تنگي نفس در حين فعاليت و سرفه بدون خلط تحريکي است. صداهاي ريه در حين گوش کردن با گوشي کاملاً تغيير نشان مي دهد. درد قفسه سينه بصورت شايع وجود دارد.
علایم اولیه:
تنگی نفس، سرفه ای که یا بدون خلط است یا خلط کمی دارد، احساس کسالت عمومی.
علایم بعدی:
نامنظمی خواب، بی اشتهایی، درد قفسه سینه، خشونت صدا، سرفه خونی، علایم نارسایی احتقانی قلب، آبی شدن ناخن ها.
علل:
مواجهه طولانی مدت با ذرات ریز آزبست به هنگام کار یا از منابع دیگر. قسمت محیطی ریه ها در اثر فیبرهای آزبست دچار آزردگی می شوند، که نهایتا التهاب، ضخیم شدگی و تشکیل بافت جوشگاهی در بافت ریوی (فیبروز ریوی) را به دنبال خواهد داشت.
عوامل افزایش دهنده خطر :
مشاغلی که در ارتباط با آزبست هستند، تغذیه نامناسب، سیگار کشیدن، سوء در مصرف الکل پیشگیری به هنگام قرار گرفتن در معرض آزبست، از ماسک حفاظتی مناسب یا هودی که با هوای آزاد ارتباط دارد استفاده کنید، اقدامات توصیه شده در رابطه با مهار غبارهای آزبست را به کار بندید، سیگار نکشید. یک برنامه منظم ورزشی داشته باشید تا سلامت قلبی – تنفسی شما حفظ شود.
برای کارگرانی که در صنایع آزبست کار می کنند باید به طور منظم عکس برداری با اشعه ایکس انجام شود تا هرگونه سایه غیرطبیعی در ریه ها شناسایی شود. اگر در عکس مشکلی بود، فرد باید کار با آزبست را رها کند حتی اگر علامتی وجود نداشته باشد. عواقب مورد انتظار این بیماری در حال حاضر غیرقابل علاج است. اما علایم را می توان تخفیف داد یا تحت کنترل درآورد، تحقیقات علمی درباره علل و درمان این بیماری ادامه دارد. بنابراین امید می رود درمان ها روز به روز موثری ابداع شوند و نهایتا بتوان این بیماری را معالجه نمود.
عوارض احتمالی :
بیماری سل، نارسایی قلبی به علت بیماری ریوی، روی هم خوابیدن بافت ریوی، جمع شدن مایع در فضای جنب (اطراف ریه ها) درمان اصول کلی: سیگار کشیدن را متوقف کنید، در صورت بروز هرگونه عفونت تنفسی، حتی سرماخوردگی، به پزشک مراجعه کنید، اگر بیماری پیشرفته باشد، به فکر نقل مکان به یک جای گرم و خشک باشید، فیزیوتراپی تنفسی و یادگیری روش های آن روش های تخلیه نایژه ای را فرا گیرید و به کار بندید، از دستگاه بخور خنک برای نرم کردن ترشحات نایژه ای استفاده کنید تا این ترشحات راحت تر تخلیه شوند، واکسیناسیون آنفلوانزا و پنوموکک (ذات الریه) را به روز نگاه دارید، از افرادی که دچار عفونت هستند دوری کنید. داروها آنتی بیوتیک برای عفونت، گشادکننده نایژه (استنشاقی یا خوراکی) همراه با استنشاق درمانی برای باز کردن لوله های نایژه ای تا حداکثر ممکن برای رفع ناراحتی خفیف می توان از داروهایی مثل استامینوفن استفاده نمود، امکان دارد اکسیژن ضروری شود. فعالیت در زمان ابتلا به این بیماری در صورت وجود عفونت، در رختخواب استراحت کنید، پس از آغاز درمان، با رو به بهبود گذاشتن علایم فعالیت در زمان ابتلا به این بیماری های عادی خود را از سر گیرید، برای حفظ ظرفیت ریه باید ورزش منظم به هر شکلی که قابل تحمل باشد انجام داد. رژیم غذایی رژیم خاصی توصیه نمی شود.
در گذشته تمامي افراد بيمار مبتلا به اين حالت، قبل از 30 سالگي مي مردند. اميد به زندگي در اين بيماران همچنان کمتر از افراد عادي است. اينها در20 تا 40 درصد موارد،بيماريشان پيشرفت خواهد کرد. اصل مهم در پيشگيري، کنترل گرد وغبار است. پاشيدن آزبست به منظور عايق کاري در هنگام ساخت ساختمان ها و بناها بايد منع شود. در دفع ضايعات کارخانجاتي که آزبست مصرف مي کنند،رعايت اصول ايمني و اقدامات پيشگيرانه جهت جلوگيري از آلودگي محيط زيست ضروري است.
fa7alveh
کاربر ممتاز تالار شیمی
فلوئور ( Fluorine )
فلوئور ( Fluorine )
فلوئور واکنش پذیرترین و الکترونگاتیویته ترین عنصر در بین تمام عناصر است. این عنصر به رنگ زرد کمرنگ و گاز خورنده با خاصیت واکنش پذیری با بیشتر مواد آلی و غیر آلی است.
همه فلزات،شیشه، سرامیک، کربن و حتی آب در فلوئور با شعله روشن می سوزند.در پروژه های بمب اتمی و انرژی هسته ای این عنصر کاربرد دارد.
کاربرد ها :
اسیدهیدروفلوریک برای روشنایی چراغ ها و لامپ ها استفاده می شود. فلوئور هیدروکربن های استفاده گسترده ای در تهویه هوا دارد. فلوئور قابلیت حلالیت در آب را دارد.
از این عنصر در خمیردندانها برای پایداری و استحکام دندان استفاده می شود و همینطور برای دندانسازی نیز کاربرد دارد. از این عنصر برای مطالعه سوختهای هسته ای نیز استفاده می شود.
درخنک کننده ها و CFC های دیگر کاربرد دارد. همچنین درساخت خمیر دندان ، فلوراید سدیم ، فلوراید قلع و تفلونها بکار می رود و فلوئورید سیدم در حشره کش ها کاربرد دارد.
سمیت :
عنصر فلوئور و یون آن بسیار سمی هستند. این عنصر به حالت آزاد در طبیعت وجود دارد دارای بوی بد و تیز است حتی با عیار پایین در طبیعت قابل کشف است.
گاز فلوئور در صنعت توليد مي شود.اين گاز بسيار خطرناک است، به طوريکه در غلظتهاي بالا باعث مرگ مي شود. اگر غلظت گاز فلوئور پايين باشد، سبب آسيبهايي گوش و چشم مي گردد.

اثرات فلوئور بر سلامتي انسان :
مقدار اندکي از فلوئور در آب، هوا، گياهان و جانوران وجود دارد. انسان از طريق غذا و آب آشاميدني و تنفس مي تواند فلوئور دريافت کند. چاي و پوسته صدفها داراي مقدار زيادي فلوئور ميباشد. فلوئور براي مقاوم شدن استخوانهاي بدن انسان يک عنصر اساسي محسوب مي شود. اگر فلوئور در خمير دندان به کار رود و دو بار در روز مصرف شود، مانع پوسيدگي دندان مي شود.
جذب و مصرف بيش از اندازه فلوئور باعث پوسيدگي دندان، پوکي استخوان، مشکلاتي در کليه ها، سيستم عصبي و ماهيچه ها مي گردد.
اثرات فلوئور بر محيط زيست :
فلوئوربه طور طبيعي در پوسته زمين، جاييکه سنگها، زغالسنگ و خاک رس وجود دارد، پيدا مي شود. فلوئوريد هيدروژن از طريق فرآيند احتراق که در صنعت انجام مي شود، وارد هوا مي شود. سپس فلوئوريدهايي که وارد هوا شده اند، وارد زمين و آب مي گردند. وقتيکه فلوئور به ذرات بسيار ريز مي چسبد، براي مدت زمان طولاني مي تواند در هوا باقي بماند. زمانيکه فلوئور از هوا وارد آب مي شود، در رسوبات ته نشين مي گردد و زمانيکه فلوئور وارد خاک مي شود، فلوئور به ذرات خاک متصل مي شود. فلوئور در طبيعت از بين نميرود، بلکه از شکلي به شکل ديگر در مي آيد. فلوئوري که در خاک جمع شده است، وارد گياهان مي شود. ميزان فلوئوري که توسط گياه جذب مي شود به عواملي مانند نوع گياه، نوع خاک و مقدار و نوع فلوئوري که در خاک موجود است، بستگي دارد. در مورد گياهاني که به فلوئور حساس هستند، حتي غلظتهاي پايين فلوئور هم باعث کند شدن رشد گياه و آسيب به برگ آنان مي شود. فلوئور به مقدار زياد جذب استخوان مي شود. در نتيجه، جانوراني که درصد بالاي فلوئور دريافت مي کنند، از بيماريهاي پوسيدگي دندان و از بين رفتن استخوان رنج مي برند.
فلوئور زياد سبب کندي جذب غذا شده و از رشد بدن جانور جلوگيري به عمل مي آيد. در نهايت، فلوئور باعث مي شود که در هنگام تولد، نوزاد جانورکم وزن باشد.
خواص فیزیکی و شیمیایی عنصر فلوئور :
عدد اتمی:9
رنگ: زرد کم رنگ و به شدت تحریک کننده
حالت استاندارد: گاز
گرمای فروپاشی: 0.51Kj/mol
گرمای تبخیر : Kj/mol 6.54
درجه اشتعال: در حالت گازی غیر قابل اشتعال
اشکال دیگر: اکسید فلوئور OF2 ، هیدرید فلوئور HF ،تترا فلوئورید کلر ClF5 ، تری فلوئورید کلر ClF3 ، فلوئورید کلر ClF ، فلوئورید کلسیم و فلوئورید آلمونیوم
منابع: کانی فلوریت
مخاطرات:
ترکیبات فلوئور موجب انفجار و آتش سوزی می شود. فلوئور و تری فلوئورید کلر و of2 اکسیدکننده قوی هستند و در غلظت های بالا خورنده اند و استنشاق فلوئور و of2 باعث ورم ریوی خونریزی و صدمه به کلیه می شود.
TWA(OSHA): یک دهم PPM یا دو دهم میلی گرم در مترمکعب می باشد.
فلوئور ( Fluorine )

فلوئور واکنش پذیرترین و الکترونگاتیویته ترین عنصر در بین تمام عناصر است. این عنصر به رنگ زرد کمرنگ و گاز خورنده با خاصیت واکنش پذیری با بیشتر مواد آلی و غیر آلی است.
همه فلزات،شیشه، سرامیک، کربن و حتی آب در فلوئور با شعله روشن می سوزند.در پروژه های بمب اتمی و انرژی هسته ای این عنصر کاربرد دارد.
کاربرد ها :
اسیدهیدروفلوریک برای روشنایی چراغ ها و لامپ ها استفاده می شود. فلوئور هیدروکربن های استفاده گسترده ای در تهویه هوا دارد. فلوئور قابلیت حلالیت در آب را دارد.
از این عنصر در خمیردندانها برای پایداری و استحکام دندان استفاده می شود و همینطور برای دندانسازی نیز کاربرد دارد. از این عنصر برای مطالعه سوختهای هسته ای نیز استفاده می شود.
درخنک کننده ها و CFC های دیگر کاربرد دارد. همچنین درساخت خمیر دندان ، فلوراید سدیم ، فلوراید قلع و تفلونها بکار می رود و فلوئورید سیدم در حشره کش ها کاربرد دارد.
سمیت :
عنصر فلوئور و یون آن بسیار سمی هستند. این عنصر به حالت آزاد در طبیعت وجود دارد دارای بوی بد و تیز است حتی با عیار پایین در طبیعت قابل کشف است.
گاز فلوئور در صنعت توليد مي شود.اين گاز بسيار خطرناک است، به طوريکه در غلظتهاي بالا باعث مرگ مي شود. اگر غلظت گاز فلوئور پايين باشد، سبب آسيبهايي گوش و چشم مي گردد.

اثرات فلوئور بر سلامتي انسان :
مقدار اندکي از فلوئور در آب، هوا، گياهان و جانوران وجود دارد. انسان از طريق غذا و آب آشاميدني و تنفس مي تواند فلوئور دريافت کند. چاي و پوسته صدفها داراي مقدار زيادي فلوئور ميباشد. فلوئور براي مقاوم شدن استخوانهاي بدن انسان يک عنصر اساسي محسوب مي شود. اگر فلوئور در خمير دندان به کار رود و دو بار در روز مصرف شود، مانع پوسيدگي دندان مي شود.
جذب و مصرف بيش از اندازه فلوئور باعث پوسيدگي دندان، پوکي استخوان، مشکلاتي در کليه ها، سيستم عصبي و ماهيچه ها مي گردد.
اثرات فلوئور بر محيط زيست :
فلوئوربه طور طبيعي در پوسته زمين، جاييکه سنگها، زغالسنگ و خاک رس وجود دارد، پيدا مي شود. فلوئوريد هيدروژن از طريق فرآيند احتراق که در صنعت انجام مي شود، وارد هوا مي شود. سپس فلوئوريدهايي که وارد هوا شده اند، وارد زمين و آب مي گردند. وقتيکه فلوئور به ذرات بسيار ريز مي چسبد، براي مدت زمان طولاني مي تواند در هوا باقي بماند. زمانيکه فلوئور از هوا وارد آب مي شود، در رسوبات ته نشين مي گردد و زمانيکه فلوئور وارد خاک مي شود، فلوئور به ذرات خاک متصل مي شود. فلوئور در طبيعت از بين نميرود، بلکه از شکلي به شکل ديگر در مي آيد. فلوئوري که در خاک جمع شده است، وارد گياهان مي شود. ميزان فلوئوري که توسط گياه جذب مي شود به عواملي مانند نوع گياه، نوع خاک و مقدار و نوع فلوئوري که در خاک موجود است، بستگي دارد. در مورد گياهاني که به فلوئور حساس هستند، حتي غلظتهاي پايين فلوئور هم باعث کند شدن رشد گياه و آسيب به برگ آنان مي شود. فلوئور به مقدار زياد جذب استخوان مي شود. در نتيجه، جانوراني که درصد بالاي فلوئور دريافت مي کنند، از بيماريهاي پوسيدگي دندان و از بين رفتن استخوان رنج مي برند.
فلوئور زياد سبب کندي جذب غذا شده و از رشد بدن جانور جلوگيري به عمل مي آيد. در نهايت، فلوئور باعث مي شود که در هنگام تولد، نوزاد جانورکم وزن باشد.
خواص فیزیکی و شیمیایی عنصر فلوئور :
عدد اتمی:9
رنگ: زرد کم رنگ و به شدت تحریک کننده
حالت استاندارد: گاز
گرمای فروپاشی: 0.51Kj/mol
گرمای تبخیر : Kj/mol 6.54
درجه اشتعال: در حالت گازی غیر قابل اشتعال
اشکال دیگر: اکسید فلوئور OF2 ، هیدرید فلوئور HF ،تترا فلوئورید کلر ClF5 ، تری فلوئورید کلر ClF3 ، فلوئورید کلر ClF ، فلوئورید کلسیم و فلوئورید آلمونیوم
منابع: کانی فلوریت
مخاطرات:
ترکیبات فلوئور موجب انفجار و آتش سوزی می شود. فلوئور و تری فلوئورید کلر و of2 اکسیدکننده قوی هستند و در غلظت های بالا خورنده اند و استنشاق فلوئور و of2 باعث ورم ریوی خونریزی و صدمه به کلیه می شود.
TWA(OSHA): یک دهم PPM یا دو دهم میلی گرم در مترمکعب می باشد.
fa7alveh
کاربر ممتاز تالار شیمی
سیلیس ( Si )
سیلیس ( Si )

اكسيد سيليسيم (SiO2) يا سيليس تركيبي شيميايي است كه به صورت خالص و يا به صورت تركيب در كاني هاي سيليكاته حدوداً 60 درصد پوسته جامد زمين را تشكيل مي دهد.
كاني هاي سيليكاته در مجموع 90 درصد پوسته زمين را تشكيل مي دهند.
سيليس خالص، بي رنگ تا سفيدرنگ است و با ترکيب SiO2 فراوان ترين ماده موجود در پوسته زمين است .
نام سيليس براي کليه کاني هايي به کار برده مي شود که داراي SiO2 مي باشند. حتي اگر از نقطه نظر بهبودی شرايط فيزيکي و شرايط زمين شناسي با هم متفاوت باشند. ماسه سنگ و ماسه سيليسي كوارتز و كوارتزيت، بلور كريستال، سيليس مصنوعي و سيليكون شيميايي، سنگ چماق و دياتوميت از منابع اصلي سيليس هستند.
سیلیس در طبیعت :
بصورت بلوری (کوارتز – کریستوبالیت و تریدیمیت) نهان بلوری (کلسدونی یا سنگ یمانی) و غیر متبلور (اوپال) موجود است.
وزن مخصوص و نقطه ذوب آن به شکل تبلور بستگی دارد.
کاربردها :
موارد استفاده از سیلیس در ساخت شیشه ها سرامیک سازی آجرهای نسوز مصالح ساختمانی و سنگ چخماق.
مخاطرات :
استنشاق غبار سیلیس معلق در هوا سبب بروز سیلیکوز که یکی از مهمترین اشکال پنوموکونیوز می باشد می شود. هر قدر تراکم غبار در هوا بیشتر و مدت تماس طولانیتر باشد خطر ابتلا به سیلیکوز بیشتر است. این گرد و غبارها در ایجاد بیماری سیلیکوزی نیز نقش دارند.

عوامل موثر در ایجاد سیلیکوز:
1- اندازه ذرات: ذراتی که اندازه آن ها بین 0.5 تا 5 میکرون باشد.
2- درجه تراکم ذرات در هوای تنفسی
3- حساسیت فردی
4- مدت زمان
فرضیه بیماری زایی سیلیس:
فرضیه ایمونولوژیکی که قابل قبول ترین نظریه در مورد ایجاد فیبروز ریوی در نتیجه استنشاق ذرات سیلیس می باشد. براساس این فرضیه ذرات سیلیس با پروتئین های ترکیب گریده سبب پیدایش آنتی زن مخصوص می گردند. ضمن اینکه میزان گاما گلوبین موجود در خون بیماران مبتلا به سیلیکوز بالا می باشد.
علایم بالینی سیلیکوز:
یک بیماری با شروع تدریجی و سیر تکاملی آهسته می باشدکه بندرت به صورت حاد دیده می شود. که سیر تکاملی آن بیش از 4 ماه نمی باشد. شامل سه مرحله است:
1- مرحله سبک: این مرحله در کسانی است که به مدت طولانی در اثر تماس با ماده بوده اند ایجاد می شود و همرا با علایم تنگی نفس و سرفه های خفیف همراه با خلط است.
2- مرحله دو یا متوسط: تنگی نفس و سرفه دو علامت بارز بوده و قدرت انبساط قفسه سینه کاهش یافته و قدرت کارایی شخص کاهش می یابد.
3- مرحله سه یا شدید: تنگسی نفس منجر به عدم توانایی کامل شخص می گردد و در ضمن در نتیجه فیبروز ریوی هیپرتروفی بطن راست و ناتوانی قلب بوجود می آید.

پیشگیری از سیلیکوزیس :
ممانعت از آلودگی هوای محیط کار به گرد و غبار سلیس ، جانشینی مواد مضر ، کاهش و یا کنترل گردو غبار استفاده از لوازم حفاظت فردی و اقدامات پزشکی.
درمان سیلیکوزیس:
با استفاده از پوشش ذرات سیلیس با اکسید آهن و استفاده از پودر آلومینیم.
سیلیس ( Si )

اكسيد سيليسيم (SiO2) يا سيليس تركيبي شيميايي است كه به صورت خالص و يا به صورت تركيب در كاني هاي سيليكاته حدوداً 60 درصد پوسته جامد زمين را تشكيل مي دهد.
كاني هاي سيليكاته در مجموع 90 درصد پوسته زمين را تشكيل مي دهند.
سيليس خالص، بي رنگ تا سفيدرنگ است و با ترکيب SiO2 فراوان ترين ماده موجود در پوسته زمين است .
نام سيليس براي کليه کاني هايي به کار برده مي شود که داراي SiO2 مي باشند. حتي اگر از نقطه نظر بهبودی شرايط فيزيکي و شرايط زمين شناسي با هم متفاوت باشند. ماسه سنگ و ماسه سيليسي كوارتز و كوارتزيت، بلور كريستال، سيليس مصنوعي و سيليكون شيميايي، سنگ چماق و دياتوميت از منابع اصلي سيليس هستند.
سیلیس در طبیعت :
بصورت بلوری (کوارتز – کریستوبالیت و تریدیمیت) نهان بلوری (کلسدونی یا سنگ یمانی) و غیر متبلور (اوپال) موجود است.
وزن مخصوص و نقطه ذوب آن به شکل تبلور بستگی دارد.
کاربردها :
موارد استفاده از سیلیس در ساخت شیشه ها سرامیک سازی آجرهای نسوز مصالح ساختمانی و سنگ چخماق.
مخاطرات :
استنشاق غبار سیلیس معلق در هوا سبب بروز سیلیکوز که یکی از مهمترین اشکال پنوموکونیوز می باشد می شود. هر قدر تراکم غبار در هوا بیشتر و مدت تماس طولانیتر باشد خطر ابتلا به سیلیکوز بیشتر است. این گرد و غبارها در ایجاد بیماری سیلیکوزی نیز نقش دارند.

عوامل موثر در ایجاد سیلیکوز:
1- اندازه ذرات: ذراتی که اندازه آن ها بین 0.5 تا 5 میکرون باشد.
2- درجه تراکم ذرات در هوای تنفسی
3- حساسیت فردی
4- مدت زمان
فرضیه بیماری زایی سیلیس:
فرضیه ایمونولوژیکی که قابل قبول ترین نظریه در مورد ایجاد فیبروز ریوی در نتیجه استنشاق ذرات سیلیس می باشد. براساس این فرضیه ذرات سیلیس با پروتئین های ترکیب گریده سبب پیدایش آنتی زن مخصوص می گردند. ضمن اینکه میزان گاما گلوبین موجود در خون بیماران مبتلا به سیلیکوز بالا می باشد.
علایم بالینی سیلیکوز:
یک بیماری با شروع تدریجی و سیر تکاملی آهسته می باشدکه بندرت به صورت حاد دیده می شود. که سیر تکاملی آن بیش از 4 ماه نمی باشد. شامل سه مرحله است:
1- مرحله سبک: این مرحله در کسانی است که به مدت طولانی در اثر تماس با ماده بوده اند ایجاد می شود و همرا با علایم تنگی نفس و سرفه های خفیف همراه با خلط است.
2- مرحله دو یا متوسط: تنگی نفس و سرفه دو علامت بارز بوده و قدرت انبساط قفسه سینه کاهش یافته و قدرت کارایی شخص کاهش می یابد.
3- مرحله سه یا شدید: تنگسی نفس منجر به عدم توانایی کامل شخص می گردد و در ضمن در نتیجه فیبروز ریوی هیپرتروفی بطن راست و ناتوانی قلب بوجود می آید.
ممانعت از آلودگی هوای محیط کار به گرد و غبار سلیس ، جانشینی مواد مضر ، کاهش و یا کنترل گردو غبار استفاده از لوازم حفاظت فردی و اقدامات پزشکی.
درمان سیلیکوزیس:
با استفاده از پوشش ذرات سیلیس با اکسید آهن و استفاده از پودر آلومینیم.
fa7alveh
کاربر ممتاز تالار شیمی
سیانید ( CN )
سیانید ( CN )

سیانید سمی می باشد.
کاربردها :
انواع مختلف دارد و از آن در تهیه الیاف مصنوعی پلاستیک ها و بیشتر به وسیله آکریلونیتریل برای از بین بردن جوندگان و حشرات ، آبکاری برق و در تهیه املاح سیانید و نیتریت ها به کار می رود.
از سیانید پتاسیم در آبکاری ، سخت کردن فولاد ، استخراج طلا و نقره از سنگ معدن ، تهیه نیتریل ها و دود دادن درختان میوه ، کشتی ها ، واگن های راه آهن ، انبارها و غیره استفاده می شود.
از سیانید کلسیم در دود دادن ، تهیه مواد کشنده جوندگان ، ساخت فولاد زنگ نزن و ثبوت سیمان استفاده می شود.
از فری سیانید پتاسیم در عکاسی ، آب دادن و آبکاری و در تولید مواد رنگی استفاده می شود.
همچنین از فرو سیانید پتاسیم در آب دادن فولاد ، گراور سازی ، تهیه مواد رنگی و رنگ کاری به عنوان یک معرف شیمیایی استفاده می شود.

مخاطرات :
مخاطرات نسبی ترکیبات از سمیت بالای برخی ترکیبات قابل حل سیانید تا سیانات های مختلطی که یا اصولا سمی نیستند و یا اینکه مسمومیت ضعیف دارند متفاوت است.
تیو سیانات ها که زمانی مصرف داروئی داشتند در گروه نسبتا بی ضرر قرار دارند.
مخاطرات تماس زیاد با این ماده ممکن است موجب خفگی و مرگ شود و این امر نتیجه تماس با غلظت های زیاد یا از راه تنفس و یا از راه جذب پوست است. بررسی های انجام شده روی کارگران صنعت آبکاری نشان داده است که درماتیتها در این صنعت مشکل به وجود آورده اند.
همچنین موارد خارش ، جوش های قرمز رنگ ، تحریک شدید بینی منجر به گرفتگی سوراخ های بینی ، خون دماغ ، ترشحات زیاد و در بعضی موارد سوراخ شدن تیغه میانی بینی دیده شده است.
انواع سیانید :
1- سیانید سدیم
2- سیانید پتاسیم
3- سیانید کلسیم
4- فری سیانید پتاسیم
5- فرو سیانید پتاسیم که حداکثر مجاز اغلب آنها 5 میلی گرم در متر مکعب می باشد.
مسمومیت ضعیف سیانید علت عمده نشانه های کمبود اکسیژن ، سردرد ، ازدیادضربان قلب و تهوع می باشد که این علایم همگی پس از قطع تماس کاملا بر طرف می شوند.
بارزترین علایم مسمومیت ، ضعف سیستم حرکتی بازوان و ساق ها ، سردرد و بیماری های غده تیروئید می باشند.
یون سیانید و ترکیبات قابل حل سیانید به راحتی از راه های مختلف تنفس ، گوارش و همینطور پوست جذب می گردند.
ویژگی سمی سیانید مربوط به از کار انداختن آنزیم هایی است که برای تنفس سلولی لازم می باشند.
با وجود اینکه سیانید می تواند 42 واکنش آنزیمی را به وسیله ترکیب با یون فلزات سنگین متوقف سازد ولی خطرناک ترین عمل آن از کار انداختن سیتو کروم اکسیداز است که به واسطه واکنش بین یون فریک و یون سیانید مانع مصرف اکسیژن مولکولی به وسیله سلول می شود که این عمل منجر به خفگی می گردد. تدابیر ایمنی توجه دقیق به تهویه مناسب ضروری است. در صورتی که احتمال مسمومیت از راه پوست وجود دارد باید از لباس محافظ استفاده نمود. علایم هشدار دهنده باید در مناطقی که سیانید مصرف می شود همچنین بر روی ظرف حمل و نقل سیانید نصب گردد که شامل کمک های اولیه می باشد.

درمان :
به دلیل اینکه سیانید موجب خفگی می شود لذا اولین کار در درمان مسمومیت حاد در صورتی که بیمار نفس نکشد تنفس مصنوعی است. اقدام بعدی درمان با نیتریت ها می باشد که شامل گرفتن آمپول نیتریت آمین جلوی بینی فرد مسموم است که این کار در مسمومیت های خفیف موثر است. در موارد شدیدتر تزریق وریدی ضرورت پیدا می کند که ابتدا 3/0 گرم نیترات سدیم و سپس 25 گرم تیو سولفات سدیم در ورید تزریق می شود.
اگر علایم عود کنند یا برنگردند باید نیم ساعت بعد نیترات سدیم و تیو سولفات سدیم را مجددا به میزان نصف مقدار تزریق شده اولیه تزریق گردد.
سیانید ( CN )

سیانید سمی می باشد.
کاربردها :
انواع مختلف دارد و از آن در تهیه الیاف مصنوعی پلاستیک ها و بیشتر به وسیله آکریلونیتریل برای از بین بردن جوندگان و حشرات ، آبکاری برق و در تهیه املاح سیانید و نیتریت ها به کار می رود.
از سیانید پتاسیم در آبکاری ، سخت کردن فولاد ، استخراج طلا و نقره از سنگ معدن ، تهیه نیتریل ها و دود دادن درختان میوه ، کشتی ها ، واگن های راه آهن ، انبارها و غیره استفاده می شود.
از سیانید کلسیم در دود دادن ، تهیه مواد کشنده جوندگان ، ساخت فولاد زنگ نزن و ثبوت سیمان استفاده می شود.
از فری سیانید پتاسیم در عکاسی ، آب دادن و آبکاری و در تولید مواد رنگی استفاده می شود.
همچنین از فرو سیانید پتاسیم در آب دادن فولاد ، گراور سازی ، تهیه مواد رنگی و رنگ کاری به عنوان یک معرف شیمیایی استفاده می شود.

مخاطرات نسبی ترکیبات از سمیت بالای برخی ترکیبات قابل حل سیانید تا سیانات های مختلطی که یا اصولا سمی نیستند و یا اینکه مسمومیت ضعیف دارند متفاوت است.
تیو سیانات ها که زمانی مصرف داروئی داشتند در گروه نسبتا بی ضرر قرار دارند.
مخاطرات تماس زیاد با این ماده ممکن است موجب خفگی و مرگ شود و این امر نتیجه تماس با غلظت های زیاد یا از راه تنفس و یا از راه جذب پوست است. بررسی های انجام شده روی کارگران صنعت آبکاری نشان داده است که درماتیتها در این صنعت مشکل به وجود آورده اند.
همچنین موارد خارش ، جوش های قرمز رنگ ، تحریک شدید بینی منجر به گرفتگی سوراخ های بینی ، خون دماغ ، ترشحات زیاد و در بعضی موارد سوراخ شدن تیغه میانی بینی دیده شده است.
انواع سیانید :
1- سیانید سدیم
2- سیانید پتاسیم
3- سیانید کلسیم
4- فری سیانید پتاسیم
5- فرو سیانید پتاسیم که حداکثر مجاز اغلب آنها 5 میلی گرم در متر مکعب می باشد.
مسمومیت ضعیف سیانید علت عمده نشانه های کمبود اکسیژن ، سردرد ، ازدیادضربان قلب و تهوع می باشد که این علایم همگی پس از قطع تماس کاملا بر طرف می شوند.
بارزترین علایم مسمومیت ، ضعف سیستم حرکتی بازوان و ساق ها ، سردرد و بیماری های غده تیروئید می باشند.
یون سیانید و ترکیبات قابل حل سیانید به راحتی از راه های مختلف تنفس ، گوارش و همینطور پوست جذب می گردند.
ویژگی سمی سیانید مربوط به از کار انداختن آنزیم هایی است که برای تنفس سلولی لازم می باشند.
با وجود اینکه سیانید می تواند 42 واکنش آنزیمی را به وسیله ترکیب با یون فلزات سنگین متوقف سازد ولی خطرناک ترین عمل آن از کار انداختن سیتو کروم اکسیداز است که به واسطه واکنش بین یون فریک و یون سیانید مانع مصرف اکسیژن مولکولی به وسیله سلول می شود که این عمل منجر به خفگی می گردد. تدابیر ایمنی توجه دقیق به تهویه مناسب ضروری است. در صورتی که احتمال مسمومیت از راه پوست وجود دارد باید از لباس محافظ استفاده نمود. علایم هشدار دهنده باید در مناطقی که سیانید مصرف می شود همچنین بر روی ظرف حمل و نقل سیانید نصب گردد که شامل کمک های اولیه می باشد.

درمان :
به دلیل اینکه سیانید موجب خفگی می شود لذا اولین کار در درمان مسمومیت حاد در صورتی که بیمار نفس نکشد تنفس مصنوعی است. اقدام بعدی درمان با نیتریت ها می باشد که شامل گرفتن آمپول نیتریت آمین جلوی بینی فرد مسموم است که این کار در مسمومیت های خفیف موثر است. در موارد شدیدتر تزریق وریدی ضرورت پیدا می کند که ابتدا 3/0 گرم نیترات سدیم و سپس 25 گرم تیو سولفات سدیم در ورید تزریق می شود.
اگر علایم عود کنند یا برنگردند باید نیم ساعت بعد نیترات سدیم و تیو سولفات سدیم را مجددا به میزان نصف مقدار تزریق شده اولیه تزریق گردد.
fa7alveh
کاربر ممتاز تالار شیمی
كادميوم ( Cd )
كادميوم ( Cd )

کادمیم در طبیعت :
اين ماده به طور طبيعي در سولفيد كادميوم معدني وجود دارد.
اين فرم ماده بسيار نادر است و بيشترين كادميوم به وسيله استخراج از ديگر سنگهاي معدني شامل سرب ، مس ،روي بدست آمده است.
سنگ معدن سولفيد روي مهمترين منبع اين ماده مي باشد، كه به وسيله تقطير مستقيم يا پروسه الكتروليت بدست مي آيد.
کاربرد ها :
اين ماده در آبكاري ساير فلزات ،سيستم ايمني آتش ، باطريهاي ذخيره كننده نيكل – كلسيم، سيماي انتقال دهنده قوي، تلويزيون هاي تابنده، رنگهاي كه در لعاب سراميك استفاده مي شود. ماشينهاي لعاب، پخت لعاب، فتو گرافي و ليتوگرافي ، يك سو كننده سلنيوم ، الكترود استفاده شده در لامپهاي گازي كادميوم ، و سلولهاي فتوالكتريك مانند ضد قارچها و پيل هاي استاندارد و ستون كه در كنترل راكتور ها استفاده مي شود.
ديگر عناوين:CAS NO.7440-43-9 و كادميوم كلوئيدي
مخاطرات :
كادميوم فلزي سميت بالایی دارد. علامتهاي مسميت ممكن است با گذشتن ساعات بسيار نشان داده شود كه شامل ادم ريوي (مايع داخل ريه ها) مهلك است. همچنين اثرات مزمن آن شامل خطرات كليوي مي باشد و بسياري از نمايندگان دولتها سرطان زايي اين ماده را تشخيص داده اند. پودر كادميوم آتش زا مي باشد و آتش قابل توجه و خطر انفجار را ايجاد مي كند.

حدود مواجهه شغلي :
1992 OSHA PEL : 8 –hr TWA=5 μg/m³
1992 OSHA SECAL : TWA= 15 or 50 μg/m³
1990 IDLH level : 50 μg/m³
1993-94 ACGIH TLVS : TWA:0.01mg/ m³ )total dust)- class A2 carcinogen
TWA:0.02 mg/ m³ (قابل تنفس )
1991 DFG (Germany)MAK : (هيچ عددي محرز نگرديد)
1992 NIUOSH REL : سرطان زا ،نگهداري در پايين ترين حد ممكن
سميت:
انسان، تنفسي : LC LO : mg/ m³ 39 در 20 دقيقه ايجاد تغييرات قلبي ،تشكيل لخته خون در عروق و فشار تنفسي
موش ،خوراكي : LD50 mg/ m³ 39 در 20 دقيقه جزئياتي گزارش نشده است
زنان ، تنفسي : LC LO : mg/ m³ 39 در 20 دقيقه پيوسته ،براي ساليان ايجاد تومور ريه مي نمايد.
مردان : TCLO: μg/m³ 88 در طي 8 سال ايجاد سميت در كليه و ميزناي و همچنين پروتئين در ادرار مي نمايد.
خواص فيزيكي :
نقطه جوش : F1409 يا C765
نقطه ذوب : F610 يا C321
فشار گاز : mm Hg 095/0 در F 6/609 يا C9/320
شاخص انكسار : 13/1
وزن مولكولي : 4/112
غلظت : 642/8
حلاليت در آب : غير قابل حل
حلاليت در ساير حلال ها : به سرعت در نيتريك حل مي شود ،به آهستگي در هيدروكروريد حل مي شود و همچنين در ديگر اسيد ها . حالت جامد اين ماده در حلال نيتريك قابليت حل شدن دارد ولي در حالت پودري در معرض خطر واكنش انفجار مي باشد.
شكل ظاهري و بو : نقره اي – سفيد ،ته رنگ آبي ،درخشان، بي بو، فلز صاف كه به راحتي با چاقو بريده مي شود و حالت پودري آن به رنگ مايل خاكستري –سفيد مي باشد.
آتش و انفجار :
وسايل اطفاء حريق مناسب : حالت جامد آتش زا نمي باشد ولي در حالت پودري ريز تابنده مي باشد(يك قانون وجود دارد كه پودر هاي كه ريزتر مي باشند پنانسيل بيشتري براي انفجار دارند) بهترين وسيله اطفاء در اين مورد دي اكسيد كربن ، پودر شيميايي خشك و شن مي باشد.
خطرات آتش هاي غير معمول يا انفجار : پروسه هاي كه گرد و غبار كادميوم توليد مي كنند مانند بريدن، آسياب كردن يا جوشكاري احتمال يك انفجار جدي را در كنار منابع احتراق وجود دارد بنابراين بايد از توليد توده گرد وغبار كادميوم جلوگيري كرد.
مقابله با آتش : آتش ممكن است توليد مواد سمي نماييد بنابراين پوشيدن تجهيزات تنفسي با حمايت كنند هاي كامل صورت در فشار ضروري يا فشار مثبت لازم مي باشد.
واكنش پذيري :
استواري / پليمريزاسيون : كادميوم به راحتي در مقابل رطوبت هوا سياه مي شود كه اين تغيير رنگ اكسيداسيون كادميوم
مي باشد. نوع فلزي كادميوم در هواي خشك پايدار ولي حالت پودري آن آتش زا مي باشد. فلز كادميوم در دماي 176 درجه فارنهايت يا 80 درجه سانتيگراد شكسته مي شود.
تركيبات ناسازگار با كادميوم : شامل آمونيوم نيتريت ،هيدروزيك اسيد، تروريم، روي، آمونياك، سولفور، سلنيوم، نيتريل فلورايد و عوامل اكسيداسيون مي باشد .
از تركيباتي كه بايد دور نگهداشته شود : توليد گرد و غبار كادميوم ،در معرض قرار گرفتن در مقابل منابع گرما و احتراق و ارتباط با مواد ناسازگار(غير قابل تركيب). توليد اكسيد كادميوم سمي مي نمايد.
خطرات بر روي سلامتي :
سرطان زايي : بر طبق ليست موسساتي كه در ذيل بيان خواهد شد كادميوم يك ماده سرطان ز ا مي باشد.
IARC CLASS 2A : ممكن است بر روي انسان سرطان ز باشد
NTP CLASS 2 : به طور معقول انتظار مي رود كه سرطان ز ا باشد
NIOSH CLASS X : سرطان ز ا
ACGIH TLV-A2 : مشكوك به سرطان زايي بر روي انسان
EPA-BI : احتمالا بر روي انسان سرطان ز ا مي باشد
DFG MAK –A2 : بي شك فقط بر روي حيوانات سرطان ز ا مي باشد
فيوم ها و گرد غبارهاي كه از طريق تنفس وارد مي شوند معمولاً ايجاد اثرات حاد در طي 24 ساعت مي نمايند.
اين اثرات شامل سند روم شبه طب انفوانزا مانند (طب فلزي ) كه داراي علائمي مانند تب و لرز ، درد عضلاني بخصوص در پشت و دست و پا مي باشد و چنانچه فرد بيشتر در معرض تماس قرار گيرد ادم ريوي (مايع در ريه) ايجاد مي گردد كه ممكن است به مرگ ختم شود . و اگر شخص احيا گردد ممكن است در قرباني تغييرات در ريه مانند فيبروز ريه و تغييرات عروقي ايجاد گردد.
تماس طولاني با كادميوم ايجاد خطراتي در كبد و كليه مي نمايد (7 تا30 سال) كه اولين علائم اختلال در لوله ها وجود پروتين در ادرار مي باشد ( گلوگز در ادرار نيز ديده شده است) همچنين كاهش تراكم استخوان در افراد در معرض كادميوم نيز ديده شده است.
اثرات مستقيم از در معرض قرار گرفتن مستقيم كادميوم گزارش نگرديده است ولي بطور غير مستقيم اين ماده بروي تنظيم كننده هاي كلسيم و فسفر موجود در كليه ها اثر دارند كه مواد مذكور بر قدرت و سلامتي استخوانها اثر مي گذارند. مطالعات نشان مي دهد كه هميشه بين آنمي(كاهش گلبولهاي خون) و بالا رفتن سطح كادميوم رابطه مستقيم وجود دارد. از سلنيوم و روي براي متوقف كردن مسموميت با كادميوم استفاده مي شود، بعنوان مثال پيوند سلنيوم و كادميوم از ورود كادميوم از طريق بافتهاي بدن جلوگيري مي كنند و روي در مكان متابوليك مشابه با كادميوم رقابت مي كند.



بدترين اختلالات پزشكي در تماسهاي دوره اي طولاني :
كليه ها ، خون ،اختلال تنفسي
اندامهاي هدف : خون ،كليه ها، كبد، سيستم هاي تنفسي
مسير هاي ورودي ابتداي : استنشاق ،قورت دادن
اثرات حاد : استنشاق ممكن است ايجاد سوزش در چشمها ، بيني و گلو همچنين تهوع و استفراغ ،اسهال، قولنج شكمي ، گرفتگي قفسه سينه ، سرفه ، سردرد و ضعف گردد. ادم ريوي بعد از 24 ساعت تماس مي تواند پيش رفت سريع داشته باشد و صدمات كليوي ممكن بعد از تماس حاد رخ دهد، ولي اين اثرات بيشتر شبيه تماسهاي مزمن مي باشد.
اثرات مزمن : اين اثرات ممكن است با تاخير بعد از گذشت چند سال بعد از آخرين تماس ايجاد مي گردد. كه شامل سوراخ شدن تيغه بيني ، كاهش حس بويايي ،برونشيت حاد، نفخ ، بي اشتهايي ، بي خوابي ، افسردگي ، آنمي ، زردي ، خطرات كليوي ، دمونيزريشن استخوان ، فيبروز ريوي ، سرطان در تنفس طولاني
كمكهاي اوليه:
چشمها : به مصدوم اجازه ندهيد چشمهاي خود را بمالد و يا محكم ببندد. پلاكها را باز و بالا نگهداريد و آب را فوراً و با شتاب و به مقدار زياد وارد چشم نماييد . و مصدوم را سريعاً به اورژانس برسانيد.
پوست : به سرعت لباسهاي آلوده را خارج نمايد ،و موضع در معرض را با آب و صابون بشويد.
دستگاه تنفسي : مصدوم را به هواي آزاد منتقل نماييد ،و در صورت لزوم از تنفس مصنوعي استفاده شود.
دستگاه گوارشي : هرگز به شخصي كه در حالت غش و تشنج مي باشد هيچ چيز نخورانيد. سعي كنيد 1 يا 2 ليوان آب به مصدوم هوشيار به خورانيد ،و هرگز شخص را وادار به استفراغ ننماييد .
دستوراتي براي پزشك : بايد ميكورگلوبين مدفوع كمتر از g/gμ 200 باشد
محافظت هاي مخصوص :
عينك ايمني : استفاده از عينكهاي ايمني ((Goggle يا ايمني در مقابل مواد شيميايي توصيه مي شود (آيين نامه 29CFR1910.133OSHA)
ماسك : در زماني كه لازم باشد و يا پوشانده كل صورت توصيه مي شود
ساير موارد : جهت جلوگيري از تماس پوستي پوشيدن دستكش ، چكمه ، پيش بند ، و دستكش بلند در زمان مواجهه با گرد و غبار كادميوم توصيه مي شود
تهويه : يك سيستم تهويه عمومي جهت پايين نگهداشتن از حد استاندارد توصيه مي شود ( ³m g/μ 5/2)
كادميوم ( Cd )

کادمیم در طبیعت :
اين ماده به طور طبيعي در سولفيد كادميوم معدني وجود دارد.
اين فرم ماده بسيار نادر است و بيشترين كادميوم به وسيله استخراج از ديگر سنگهاي معدني شامل سرب ، مس ،روي بدست آمده است.
سنگ معدن سولفيد روي مهمترين منبع اين ماده مي باشد، كه به وسيله تقطير مستقيم يا پروسه الكتروليت بدست مي آيد.
کاربرد ها :
اين ماده در آبكاري ساير فلزات ،سيستم ايمني آتش ، باطريهاي ذخيره كننده نيكل – كلسيم، سيماي انتقال دهنده قوي، تلويزيون هاي تابنده، رنگهاي كه در لعاب سراميك استفاده مي شود. ماشينهاي لعاب، پخت لعاب، فتو گرافي و ليتوگرافي ، يك سو كننده سلنيوم ، الكترود استفاده شده در لامپهاي گازي كادميوم ، و سلولهاي فتوالكتريك مانند ضد قارچها و پيل هاي استاندارد و ستون كه در كنترل راكتور ها استفاده مي شود.
ديگر عناوين:CAS NO.7440-43-9 و كادميوم كلوئيدي
مخاطرات :
كادميوم فلزي سميت بالایی دارد. علامتهاي مسميت ممكن است با گذشتن ساعات بسيار نشان داده شود كه شامل ادم ريوي (مايع داخل ريه ها) مهلك است. همچنين اثرات مزمن آن شامل خطرات كليوي مي باشد و بسياري از نمايندگان دولتها سرطان زايي اين ماده را تشخيص داده اند. پودر كادميوم آتش زا مي باشد و آتش قابل توجه و خطر انفجار را ايجاد مي كند.

حدود مواجهه شغلي :
1992 OSHA PEL : 8 –hr TWA=5 μg/m³
1992 OSHA SECAL : TWA= 15 or 50 μg/m³
1990 IDLH level : 50 μg/m³
1993-94 ACGIH TLVS : TWA:0.01mg/ m³ )total dust)- class A2 carcinogen
TWA:0.02 mg/ m³ (قابل تنفس )
1991 DFG (Germany)MAK : (هيچ عددي محرز نگرديد)
1992 NIUOSH REL : سرطان زا ،نگهداري در پايين ترين حد ممكن
سميت:
انسان، تنفسي : LC LO : mg/ m³ 39 در 20 دقيقه ايجاد تغييرات قلبي ،تشكيل لخته خون در عروق و فشار تنفسي
موش ،خوراكي : LD50 mg/ m³ 39 در 20 دقيقه جزئياتي گزارش نشده است
زنان ، تنفسي : LC LO : mg/ m³ 39 در 20 دقيقه پيوسته ،براي ساليان ايجاد تومور ريه مي نمايد.
مردان : TCLO: μg/m³ 88 در طي 8 سال ايجاد سميت در كليه و ميزناي و همچنين پروتئين در ادرار مي نمايد.
خواص فيزيكي :
نقطه جوش : F1409 يا C765
نقطه ذوب : F610 يا C321
فشار گاز : mm Hg 095/0 در F 6/609 يا C9/320
شاخص انكسار : 13/1
وزن مولكولي : 4/112
غلظت : 642/8
حلاليت در آب : غير قابل حل
حلاليت در ساير حلال ها : به سرعت در نيتريك حل مي شود ،به آهستگي در هيدروكروريد حل مي شود و همچنين در ديگر اسيد ها . حالت جامد اين ماده در حلال نيتريك قابليت حل شدن دارد ولي در حالت پودري در معرض خطر واكنش انفجار مي باشد.
شكل ظاهري و بو : نقره اي – سفيد ،ته رنگ آبي ،درخشان، بي بو، فلز صاف كه به راحتي با چاقو بريده مي شود و حالت پودري آن به رنگ مايل خاكستري –سفيد مي باشد.
آتش و انفجار :
وسايل اطفاء حريق مناسب : حالت جامد آتش زا نمي باشد ولي در حالت پودري ريز تابنده مي باشد(يك قانون وجود دارد كه پودر هاي كه ريزتر مي باشند پنانسيل بيشتري براي انفجار دارند) بهترين وسيله اطفاء در اين مورد دي اكسيد كربن ، پودر شيميايي خشك و شن مي باشد.
خطرات آتش هاي غير معمول يا انفجار : پروسه هاي كه گرد و غبار كادميوم توليد مي كنند مانند بريدن، آسياب كردن يا جوشكاري احتمال يك انفجار جدي را در كنار منابع احتراق وجود دارد بنابراين بايد از توليد توده گرد وغبار كادميوم جلوگيري كرد.
مقابله با آتش : آتش ممكن است توليد مواد سمي نماييد بنابراين پوشيدن تجهيزات تنفسي با حمايت كنند هاي كامل صورت در فشار ضروري يا فشار مثبت لازم مي باشد.
واكنش پذيري :
استواري / پليمريزاسيون : كادميوم به راحتي در مقابل رطوبت هوا سياه مي شود كه اين تغيير رنگ اكسيداسيون كادميوم
مي باشد. نوع فلزي كادميوم در هواي خشك پايدار ولي حالت پودري آن آتش زا مي باشد. فلز كادميوم در دماي 176 درجه فارنهايت يا 80 درجه سانتيگراد شكسته مي شود.
تركيبات ناسازگار با كادميوم : شامل آمونيوم نيتريت ،هيدروزيك اسيد، تروريم، روي، آمونياك، سولفور، سلنيوم، نيتريل فلورايد و عوامل اكسيداسيون مي باشد .
از تركيباتي كه بايد دور نگهداشته شود : توليد گرد و غبار كادميوم ،در معرض قرار گرفتن در مقابل منابع گرما و احتراق و ارتباط با مواد ناسازگار(غير قابل تركيب). توليد اكسيد كادميوم سمي مي نمايد.
خطرات بر روي سلامتي :
سرطان زايي : بر طبق ليست موسساتي كه در ذيل بيان خواهد شد كادميوم يك ماده سرطان ز ا مي باشد.
IARC CLASS 2A : ممكن است بر روي انسان سرطان ز باشد
NTP CLASS 2 : به طور معقول انتظار مي رود كه سرطان ز ا باشد
NIOSH CLASS X : سرطان ز ا
ACGIH TLV-A2 : مشكوك به سرطان زايي بر روي انسان
EPA-BI : احتمالا بر روي انسان سرطان ز ا مي باشد
DFG MAK –A2 : بي شك فقط بر روي حيوانات سرطان ز ا مي باشد
فيوم ها و گرد غبارهاي كه از طريق تنفس وارد مي شوند معمولاً ايجاد اثرات حاد در طي 24 ساعت مي نمايند.
اين اثرات شامل سند روم شبه طب انفوانزا مانند (طب فلزي ) كه داراي علائمي مانند تب و لرز ، درد عضلاني بخصوص در پشت و دست و پا مي باشد و چنانچه فرد بيشتر در معرض تماس قرار گيرد ادم ريوي (مايع در ريه) ايجاد مي گردد كه ممكن است به مرگ ختم شود . و اگر شخص احيا گردد ممكن است در قرباني تغييرات در ريه مانند فيبروز ريه و تغييرات عروقي ايجاد گردد.
تماس طولاني با كادميوم ايجاد خطراتي در كبد و كليه مي نمايد (7 تا30 سال) كه اولين علائم اختلال در لوله ها وجود پروتين در ادرار مي باشد ( گلوگز در ادرار نيز ديده شده است) همچنين كاهش تراكم استخوان در افراد در معرض كادميوم نيز ديده شده است.
اثرات مستقيم از در معرض قرار گرفتن مستقيم كادميوم گزارش نگرديده است ولي بطور غير مستقيم اين ماده بروي تنظيم كننده هاي كلسيم و فسفر موجود در كليه ها اثر دارند كه مواد مذكور بر قدرت و سلامتي استخوانها اثر مي گذارند. مطالعات نشان مي دهد كه هميشه بين آنمي(كاهش گلبولهاي خون) و بالا رفتن سطح كادميوم رابطه مستقيم وجود دارد. از سلنيوم و روي براي متوقف كردن مسموميت با كادميوم استفاده مي شود، بعنوان مثال پيوند سلنيوم و كادميوم از ورود كادميوم از طريق بافتهاي بدن جلوگيري مي كنند و روي در مكان متابوليك مشابه با كادميوم رقابت مي كند.



كليه ها ، خون ،اختلال تنفسي
اندامهاي هدف : خون ،كليه ها، كبد، سيستم هاي تنفسي
مسير هاي ورودي ابتداي : استنشاق ،قورت دادن
اثرات حاد : استنشاق ممكن است ايجاد سوزش در چشمها ، بيني و گلو همچنين تهوع و استفراغ ،اسهال، قولنج شكمي ، گرفتگي قفسه سينه ، سرفه ، سردرد و ضعف گردد. ادم ريوي بعد از 24 ساعت تماس مي تواند پيش رفت سريع داشته باشد و صدمات كليوي ممكن بعد از تماس حاد رخ دهد، ولي اين اثرات بيشتر شبيه تماسهاي مزمن مي باشد.
اثرات مزمن : اين اثرات ممكن است با تاخير بعد از گذشت چند سال بعد از آخرين تماس ايجاد مي گردد. كه شامل سوراخ شدن تيغه بيني ، كاهش حس بويايي ،برونشيت حاد، نفخ ، بي اشتهايي ، بي خوابي ، افسردگي ، آنمي ، زردي ، خطرات كليوي ، دمونيزريشن استخوان ، فيبروز ريوي ، سرطان در تنفس طولاني
كمكهاي اوليه:
چشمها : به مصدوم اجازه ندهيد چشمهاي خود را بمالد و يا محكم ببندد. پلاكها را باز و بالا نگهداريد و آب را فوراً و با شتاب و به مقدار زياد وارد چشم نماييد . و مصدوم را سريعاً به اورژانس برسانيد.
پوست : به سرعت لباسهاي آلوده را خارج نمايد ،و موضع در معرض را با آب و صابون بشويد.
دستگاه تنفسي : مصدوم را به هواي آزاد منتقل نماييد ،و در صورت لزوم از تنفس مصنوعي استفاده شود.
دستگاه گوارشي : هرگز به شخصي كه در حالت غش و تشنج مي باشد هيچ چيز نخورانيد. سعي كنيد 1 يا 2 ليوان آب به مصدوم هوشيار به خورانيد ،و هرگز شخص را وادار به استفراغ ننماييد .
دستوراتي براي پزشك : بايد ميكورگلوبين مدفوع كمتر از g/gμ 200 باشد
محافظت هاي مخصوص :
عينك ايمني : استفاده از عينكهاي ايمني ((Goggle يا ايمني در مقابل مواد شيميايي توصيه مي شود (آيين نامه 29CFR1910.133OSHA)
ماسك : در زماني كه لازم باشد و يا پوشانده كل صورت توصيه مي شود
ساير موارد : جهت جلوگيري از تماس پوستي پوشيدن دستكش ، چكمه ، پيش بند ، و دستكش بلند در زمان مواجهه با گرد و غبار كادميوم توصيه مي شود
تهويه : يك سيستم تهويه عمومي جهت پايين نگهداشتن از حد استاندارد توصيه مي شود ( ³m g/μ 5/2)
fa7alveh
کاربر ممتاز تالار شیمی
جیوه ( Hg )
جیوه ( Hg )

ترکیبات جیوه :
( compounds of Mercury )
کابردهای جیوه :
بیشترین کاربرد جیوه در ساخت مواد شیمیایی صنعتی و کاربردهای برقی و الکترونیکی است. علاوه بر اینها از جیوه در دماسنجها بخصوص برای حرارتهای بالا مورد استفاده قرار میگیرد.
چون بهآسانی با طلا تولید آمالگام میکند، برای تهیه طلا از سنگ معدن مورد استفاده قرار میگیرد.
از جیوه علاوه بر دماسنجها در فشارسنجها، پمپهای انتشار و بسیاری وسایل آزمایشگاهی دیگراستفاده میگردد.
نقطه سه گانه جیوه 8344/38 درجه سانتیگراد ، نقطه ثابتی است که بعنوان معیار در مقیاسهای بینالمللی حرارتی (ITS-90) بکار رفته است.
از جیوه گازی در لامپهای بخار جیوه و تابلوهای تبلیغاتی استفاده میشود.
کاربردهای متنوع جیوه:
سویچهای جیوه ای، حشره کشها، آمالگامها/ داروهای دندان، باتریهای جیوهای برای تولید هیدروکسید سدیم و کلر، الکترود در برخی انواع الکترولیز، باتریها (پیلهای جیوهای) و کاتالیزورها.

[h=2]خطرات تجمع بیش از حد جیوه در بدن :
[/h]تجمع بيش از اندازه جيوه در بدن در سیستم عصبی اختلال ايجاد ميکند و نهايتاً منجر به بی حسی و خارش انگشتان دست، پا و لبها ميشود.
همچنين سبب ميشود تا کودکان ديرتر از موعد مقرر، شروع به صحبت کردن و راه رفتن کنند. از ديگر عوارض آن ميتوان به دردهاي مفصلی و ماهيچهاي و افزايش خطر حملات قلبی اشاره کرد.
در طول دوران جنيني، جنين به علت رشد سريع سيستم عصبي در برابر اثرات سمي مقادير بالاي متيل جيوه آسيبپذيرتر است. متيل جيوه به راحتي از جفت عبور ميکند و غلظت جيوه در گلبولهاي قرمز خون جنين 30 درصد بيشتر از مقدار خون مادر است. متيل جيوه تأثيرات مخربي بر رشد جنين دارد که 5 تا 10 برابر تأثيرات مخرب آن بر انسان بالغ است.
جیوه ( Hg )

ترکیبات جیوه :
( compounds of Mercury )
| کارن وترهان یک پروفسور بین المللی شیمی و یک محقق ماهر در زمینه اثر فلزات سنگین بر روی سیستم های زنده و بویژه نقششان در ایجاد سرطان بود . اما خود او سرانجام قربانی یک فلز سنگین سمی شد . او در حال مطالعه طریقه ی اثر کردن یونهای جیوه بر پروتیینهای تعمیر کننده DNA بود و Hg(CH۳)۲ را به عنوان یک ماده مرجع استاندارد برای اندازه گیری ۱۹۹Hg NMR بکار برد. وترهان از سمی بودن بسیار جیوه آگاه بود و برای همین اقدامات احتیاطی لازم را بکار برد ،در حالیکه عینک ایمنی می زد و از دست کش های لاستیکی استفاده می کرد آزمایش را در زیر یک هود انجام می داد و تنها با مقادیر کوچک ماده ی جیوه ای کار میکرد. دی متیل جیوه در یک سل شیشه ای بسته شده قرار گرفت .یکی از همکارانش برای کاهش اثر فراریت این ماده ،سل را در آب یخ سرد می کرد . وترهان یک نمونه ی کوچک را با پیپت به لوله NMR انتقال داد ،ظرف را بست ،لوله ها را برچسب زد و دستکش های لاستیکی اش را به خوبی شستشو داد و دور انداخت . کمتر از یکسال او به واسطه اثر جیوه ی سمی کشته شد !!! چرا او مرد؟ وترهان بعد ها به یاد آورد که یک قطره ( احتمالا بیشتر ) از دی متیل جیوه بر روی دستکشهایش ریخته است. متعاقبا آزمایشها نشان داد که این قطره توانسته از دستکش نفوذ کند و ظرف مدت ۱۵ ثانیه وارد پوستش شده است . امروزه هنگام کار کردن با ترکیبات سمی این چنینی از دستکشهایی که یک ورقه مقاوم دارند در زیر یک جفت دستکش های آستین دار نیوپرن استفاده میکنند. در ژانویه ۱۹۹۷ وترهان از ظهور علایم معینی نظیر لرزش انگشتان دست و پا و لکنت زبان نگران شد . سپس مشکلاتی از بابت تعادلش آغاز شد و زمینه دیدش کم شد . جیوه سمی در ۲۸ ژانویه ۱۹۹۷ تشخیص داده شد . آزمایشها معلوم کردند که میزان جیوه خون ، ۴۰۰۰ میکروگرم بر لیتر است که ۸۰ برابر آستانه سمی بودن است . دو هفته بعد او به حالت اغما رفت و مرگ او در ۸ ژوین ۱۹۹۷ رخ داد . 
دی متیل جیوه در دمای اتاق مایع است و بوی کمی شیرینی دارد . در فشار اتمسفر نقطه جوشش ۹۲ ۰C است و دانسیته اش (چگالی )۹۶/۲ گرم بر سانتیمتر مکعب است . دی متیل جیوه از نظر شکلی ساختار خطی دارد و شبیه بسیاری از سیستمهای HgX۲است . (طول پیوند Hg – C برابر ۰۸۳/۲ انگستروم است) دی متیل جیوه یکی از قویترین سموم اعصاب شناخته شده است . این ماده به راحتی از سد خون – مغز می گذرد و شاید منجر به تشکیل یک کمپلکس متیل جیوه سیستیین شود . این ترکیب سبب اختلال حسی ،فقدان تعادلی و تغییر در حالت روانی میشود. به طور کلی جیوه یک اسید نرم است بنابراین با اتمهای دهنده ی براحتی قطبش پذیر در بازهای نرم پیوند می شود .این به یون جیوه تمایل زیادی برای پیوند با گوگرد و لیگاندهای حاوی اتم گوگرد را می دهد .بنابراین هنگامی که وارد بدن شد به گروههای تیول آنزیمها حمله می کند و از عملکرد آنها جلوگیری میکند. Zeise اولین لیگاند های مرکاپتان را ساخت و نامشان را بر اساس عبارت لاتین Mercurium captans (تسخیر کننده و اسیرکننده ی جیوه Capturing mercury ) ابداع کرد. سنگ معدن اصلی جیوه سولفور سیماب HgS است . که از معادن مهمی نظیر Almaden در اسپانیا و Idria و Serbia و Monte Amiata در ایتالیا استخراج میشود. در زمان رومی ها جنایتکارانی که به کار در معادن جیوه محکوم میشدند به دلیل خاصیت سمی جیوه طول عمر کوتاهی داشتند. در حقیقت به نوعی این مجازات مرگ برای ایشان بود .Pliny علایم جیوه سمی را در قرن اول میلادی شرح داد .شنگرف یا سولفورسیماب بعنوان یک دانه ی رنگی و به طور گسترده در جهان باستان به کار میرفت . 
در یک زمانی مردم از جیوه و ترکیباتش برای درمان سیفلیس استفاده می کردند. اگر چه موفقیت آمیز نبود اما برای یک زمان قابل توجهی رواج داشت تا اینکه پنی سیلین که یک داروی موثر برای مراحل اولیه این بیماری بود کشف شد . یکی دیگر از موارد استفاده از جیوه استفاده از آنها در کلاه سازی بود . ۲۰۰ سال پیش خزهای بکار رفته برای ساختن قسمت پایینی کلاه های نمدی در محلول نیترات جیوه (II) به عنوان یک محافظ و برای نرم کردن موهای حیوانات غوطه ور می شدند .متاسفانه کارگرانی که در این قسمت فعالیت داشتند بدلیل جذب جیوه از طریق پوستشان دچار لرزش و لکنت زبان میشدند . به این بیماری در گذشته بیماری کلاهدوزان می گفتند . که اعتقاد داشتند از شخصیت کلاهدوز عصبانی در داستان آلیس در سرزمین عجایب الهام گرفته است . استفاده دیگر از ترکیبات آلکیل جیوه ،استفاده در قارچ کش های دانه ها بو د. بین جنگ های جهانی کارگران ساخت قارچ کش های گیاهی ،جیوه سمی را گسترش دادند . در سال ۱۹۴۲ دو جوان منشی کانادایی بدلیل حضور در یک انبار گمرکی در کانادا به طرز شدیدی مسموم شدند . در انبار گمرک دانه های عمل شده با جیوه وجود داشت . در سال ۱۹۶۰ کشاورزان سویدی متوجه شدند که پرندگان به طرز اسفناکی به روی زمین می افتند و می میرند . پرندگان دانه های عمل شده با جیوه یا حیوانانی که چنین دانه هایی را مصرف کرده بودند خورده بودند و به چنین سرنوشتی گرفتار شده بودند . |
کابردهای جیوه :
بیشترین کاربرد جیوه در ساخت مواد شیمیایی صنعتی و کاربردهای برقی و الکترونیکی است. علاوه بر اینها از جیوه در دماسنجها بخصوص برای حرارتهای بالا مورد استفاده قرار میگیرد.
چون بهآسانی با طلا تولید آمالگام میکند، برای تهیه طلا از سنگ معدن مورد استفاده قرار میگیرد.
از جیوه علاوه بر دماسنجها در فشارسنجها، پمپهای انتشار و بسیاری وسایل آزمایشگاهی دیگراستفاده میگردد.
نقطه سه گانه جیوه 8344/38 درجه سانتیگراد ، نقطه ثابتی است که بعنوان معیار در مقیاسهای بینالمللی حرارتی (ITS-90) بکار رفته است.
از جیوه گازی در لامپهای بخار جیوه و تابلوهای تبلیغاتی استفاده میشود.
کاربردهای متنوع جیوه:
سویچهای جیوه ای، حشره کشها، آمالگامها/ داروهای دندان، باتریهای جیوهای برای تولید هیدروکسید سدیم و کلر، الکترود در برخی انواع الکترولیز، باتریها (پیلهای جیوهای) و کاتالیزورها.

[/h]تجمع بيش از اندازه جيوه در بدن در سیستم عصبی اختلال ايجاد ميکند و نهايتاً منجر به بی حسی و خارش انگشتان دست، پا و لبها ميشود.
همچنين سبب ميشود تا کودکان ديرتر از موعد مقرر، شروع به صحبت کردن و راه رفتن کنند. از ديگر عوارض آن ميتوان به دردهاي مفصلی و ماهيچهاي و افزايش خطر حملات قلبی اشاره کرد.
در طول دوران جنيني، جنين به علت رشد سريع سيستم عصبي در برابر اثرات سمي مقادير بالاي متيل جيوه آسيبپذيرتر است. متيل جيوه به راحتي از جفت عبور ميکند و غلظت جيوه در گلبولهاي قرمز خون جنين 30 درصد بيشتر از مقدار خون مادر است. متيل جيوه تأثيرات مخربي بر رشد جنين دارد که 5 تا 10 برابر تأثيرات مخرب آن بر انسان بالغ است.
ارسنیک
ارسنیک
آرسنيك فلزي سنگين ، بسيار سمي مي باشد كه در خاك ، آب و هوا وجود دارد در جدول زير به تعدادي از آنها اشاره شده است . استفاده از حشره كش ها ، علف كش هاي حاوي آرسنيك ميانگين آرسنيك موجود در محيط اطراف را افزايش مي دهد و منجر به ورود اين ماده سمي به چرخه غذايي و از آنجا به بدن انسان مي شود و سلامت انسان را به مخاطره مي اندازد .
اين عنصر به سه فرم فلزي ، سه ظرفيتي و پنج ظرفيتي وجود دارد . ميزان سميت هر يك از فرم هاي آرسنيك به سرعت دفع آن از بدن و درجه تجمع در بافت هاي سلولي بستگي دارد. كه ميزان سميت آرسنيك به سرعت دفع آن از بدن و درجه تجمع در بافت هاي سلولي بستگي دارد . ميزان سميت آرسنيك آلي كمتر بوده در مقابل آرسنيك غير آلي تمايل بيشتري به برقراري پيوند با پروتئين هاي حاوي گروه SH دارد و به همين جهت سمي تر است .
مخاطرات
این عنصر سمي كه در بسياري از مواقع سلامت و جان آدمي را به خطر انداخته و باعث بيماري كبدي ، سرطان پوست و ريه و ... شده
اهميت آرسنيك به دليل ايجاد اختلال در سنتز DNA و RNA مي باشد كه در نتيجه آن سرطان حاصل مي گردد.
افزايش تولد كودكان استثنائي ، تولد با وزن كم ، تولد كودكان ناهنجار و بدنيا آمدن نوزادان مرده به علت ورود تركيبات آرسنيك دار مشاهده مي شود .
مسموميت مزمن آرسنيك بعد از يك دوره طولاني ( بين 5 تا 20 روز ) در معرض قرار داشتن آرسنيك به وجود مي آيد كه علائم مسموميت حاد بلافاصله ظاهر مي شود كه شامل : تهوع ، درد در دستگاه گوارشي و اسهال مي باشد . قرار داشتن در معرض آرسنيك حتي در مقادير كم ( 0.05 ميلي گرم در ليتر ) خطر ابتلا به سرطان پوست ، ريه مجاري ادراري ، مثانه و كليه را افزايش مي دهد .
هم چنين باعث تغييرات پوستي ( ايجاد لكه هاي تيره يا روشن در پوست ) افزايش ضخامت يا بر آمدگي زرد رنگ روي پوست ( شاخي شدن پوست ) ،
اثرات سوء روي سيستم عصبي ( لرزش و درد در ناحيه سر ) از ديگر عوارض مسموميت به آرسنيك مي باشد.
تنفس بخارات آرسنيك موجب بيماري هاي دستگاه تنفسي از جمله برونشيت ، لارنژيت و تورم غشاي مخاطي مي شود .
تأثير آرسنيك بر روي معده و روده نيز ديده كه از علائم آن سوزش لب ها ، بلع همراه با درد ، تشنگي و قولنج ، تهوع و اسهال مي باشد .
در ادامه باعث كم خوني و كاهش گلبول سفيد و مهار سنتز گلبول هاي قرمز ايجاد مي شود و مقادير بالاي آرسنيك موجب ضعف در مغز استخوان مي شود .
هم چنين تحقيقات نشان مي دهد كه ميان آرسنيك و ابتلا به ديابت ارتباط مستقيمي وجود دارد.
آنا ناواس آسين از دانشكده بهداشت عمومي جانز هاپكينز بلومبرگ در بالتيمور و همكارانش ۷۸۸ فرد بالاي ۲۰سال را بررسي كردند. مقدار آرسنيك در ادرار اين افراد آزمايش شد.
محققان دريافتند ۷/۷درصد از شركتكنندگان به ديابت نوع دوم مبتلا هستند كه پس از در نظر گرفتن ساير عوامل خطر در بروز ديابت مشخص شد كه ميزان آرسنيك در ادرار اين افراد ۲۶درصد بيشتر از افراد غيرمبتلا به ديابت است .
اين مطالعات نشان داد بيش از 20 درصد از شركت كنندگاني كه بالاترين ميزان آرسنيك ( 5/16 ميكروگرم در ليتر ) را در ادرار خود داشتند 6/3 درصد بيش از كساني كه كمترين ميزان آرسنيك ( 3 ميكرو گرم در ليتر ) در ادرارشان داشتند به ديابت نوع دوم مبتلا شدند .
محققان به اين نتيجه رسيدند كه آرسنيك ميتواند بر عوامل ژنتيكي كه در حساسيت انسولين و ساير فرايندها دخالت دارد تاثير بگذارد و يا در آسيب سلولي مرتبط با اكسيژن ، التهاب و مرگ سلولي نيز كه با ديابت مرتبط است، نقش داشته باشد .
* در مواردي نيز این عنصر مخوف به تداوم زندگي انسان مدد نموده كه از جمله آنهامي توان به التيام زخم ها ، درمان طاعون ، سرطان خون حاد ، مالاريا ، سيفليس ، تريپانوزوميازيس و بيماري رماتيسمي اشاره نمود .
راههای ورود به بدن
آرسنيت 3 ظرفيتي و آرسنات 5 ظرفيتي در آب آشاميدني بيشتر يافت مي شود. مسموميت آب آرسنيك مي توان در اثر گذر آب از صخره هاي غني از آرسنيك و يا آرسنيك موجود در قشر خاك بستر آب رودخانه ها و يا ورود فاضلاب هاي صنعتي به رودخانه ها حاصل مي شود .
اين آب آلوده توسط گياهان و جانوران يا به طور مستقيم توسط خود انسان مصرف مي شود و وارد چرخه غذايي انسان شده و سلامت آن را به مخاطره مي اندازد.
به طور مثال بيماري كبدي شايع در ماهيگيران ژاپني كه به علت مصرف ماهي هاي آلوده به آرسنيك بوجود آمده است .
اندازه گیری ارسنیک
اندازه گيري آرسنيك موجود در آب به روش هاي مختلفي صورت مي گيرد ، اهم اين روش ها استفاده از دستگاه جذب اتمي بصورت هيدريد ، استفاده از روش يدومتري بوسيله نقره در اتيل دي يتو كاربامات به روش اسپكترو فتو متري مي باشد . در صورتي كه مقدار آرسنيك موجود در آب بيشتر از حد استاندارد بود مي توان از طريق آهك زني و ته نشيني الكتريكي اسمز معكوس و تعويض يون مقدار اضافي را حذف نمود .
روشهای حذف ارسنیک
از روش هاي اميد بخشي كه ميتوان به راحتي آرسنيك را از آب جدا نمود و آن را به آب سالم تبديل كرد استفاده از بلورهاي نازك زنگ آهن است .
ذرات اكسيد آهن مي توانند به مقدار زياد با آرسنيك موجود در آب پيوند برقرار نمايند
از ديگر روش ها حذف آرسنيك با استفاده از آلوميناي فعال اصلاح شده با تركيبات آهني مي باشد كه اين آلومينا محصول آلكان كانادا با نام تجاري 50AAFS- است.
آزمايشهاي تعادلي در حالت منقطع با استفاده از همزن انجام گرفت و آرسينيك به روش SDDC آناليز شد .
ارسنیک
آرسنيك فلزي سنگين ، بسيار سمي مي باشد كه در خاك ، آب و هوا وجود دارد در جدول زير به تعدادي از آنها اشاره شده است . استفاده از حشره كش ها ، علف كش هاي حاوي آرسنيك ميانگين آرسنيك موجود در محيط اطراف را افزايش مي دهد و منجر به ورود اين ماده سمي به چرخه غذايي و از آنجا به بدن انسان مي شود و سلامت انسان را به مخاطره مي اندازد .
آرسنيک | � | |||
| نام بيمارى | کراتوسيزوفشار خون | سرطان پوست | سرطان مثانه | قانقاريا و سرطان ريه |
| علائم ناشى از آلودگى به عنصر | مشکلات پوستى روى دست و پا وتخريب مجارى بينى | سرگيجه مشکلات تنفسى و گرفتگى عضلات | پوکى و شکنندگى استخوان | اختلالات کليوى، کم خونى و از بين رفتن حسبويايى |
| منابع آلودگى | زهاب معادن فلزى متروک و سوزاندن زغالهاى غنى از آرسنيک | تسويه کانه هاى سولفيدى حاوى آرسنيک | سدهاى باطله و سنگ ها ى آلوده به آرسنيک | زهاب هاى حاصل از فعاليت هاى معدنى و کانه آرايى |
| رفتار عنصر در طبيعت | آرسنيک دربدن ماهيها و حلزونها تجمع مى يابد که اين آرسنيک خطرى در بر ندارد. | بيشتر ترکيبات آرسنيک در آب حل مى شود. | آرسنيک در طبيعت از بين نمى رود بلکه از شکلى به شکل ديگر تغيير مى کند. | آرسنيک موجود در هوا روى زمين مى نشيند و بواسطه آب باران شسته مى شود. |
| ملاحظات | معمولاٌ آرسنيک با عناصر طلا، مس و روى همراه مى باشد. | آزمايش ، مو و خون براى اندازه گيرى آرسنيک در بدن استفاده مى شود. | هضم مقادير بالاى آرسنيک کشنده است. | |
| � | ||||
| حد مجاز | مرجع استاندارد | � | ||
| ّآب | 0/05(ppm) | EPA | NIOSH | National Institue for Occupational Safety and Helth |
| 10-50(μg/lit) | WHO | � | ||
| 0/1(mg/lit) | ACGIH | OSHA | Occupational Safety and Health Administration | � |
| هوا | 10(μg/m3) | OSHA | WHO | WorldHealth Organization |
| 0/25(mg/m3) | ACGIH | � | ||
| خاک | EPA | Environment Protection Agency | � |
اين عنصر به سه فرم فلزي ، سه ظرفيتي و پنج ظرفيتي وجود دارد . ميزان سميت هر يك از فرم هاي آرسنيك به سرعت دفع آن از بدن و درجه تجمع در بافت هاي سلولي بستگي دارد. كه ميزان سميت آرسنيك به سرعت دفع آن از بدن و درجه تجمع در بافت هاي سلولي بستگي دارد . ميزان سميت آرسنيك آلي كمتر بوده در مقابل آرسنيك غير آلي تمايل بيشتري به برقراري پيوند با پروتئين هاي حاوي گروه SH دارد و به همين جهت سمي تر است .
مخاطرات
این عنصر سمي كه در بسياري از مواقع سلامت و جان آدمي را به خطر انداخته و باعث بيماري كبدي ، سرطان پوست و ريه و ... شده
اهميت آرسنيك به دليل ايجاد اختلال در سنتز DNA و RNA مي باشد كه در نتيجه آن سرطان حاصل مي گردد.
افزايش تولد كودكان استثنائي ، تولد با وزن كم ، تولد كودكان ناهنجار و بدنيا آمدن نوزادان مرده به علت ورود تركيبات آرسنيك دار مشاهده مي شود .
مسموميت مزمن آرسنيك بعد از يك دوره طولاني ( بين 5 تا 20 روز ) در معرض قرار داشتن آرسنيك به وجود مي آيد كه علائم مسموميت حاد بلافاصله ظاهر مي شود كه شامل : تهوع ، درد در دستگاه گوارشي و اسهال مي باشد . قرار داشتن در معرض آرسنيك حتي در مقادير كم ( 0.05 ميلي گرم در ليتر ) خطر ابتلا به سرطان پوست ، ريه مجاري ادراري ، مثانه و كليه را افزايش مي دهد .
هم چنين باعث تغييرات پوستي ( ايجاد لكه هاي تيره يا روشن در پوست ) افزايش ضخامت يا بر آمدگي زرد رنگ روي پوست ( شاخي شدن پوست ) ،
اثرات سوء روي سيستم عصبي ( لرزش و درد در ناحيه سر ) از ديگر عوارض مسموميت به آرسنيك مي باشد.
تنفس بخارات آرسنيك موجب بيماري هاي دستگاه تنفسي از جمله برونشيت ، لارنژيت و تورم غشاي مخاطي مي شود .
تأثير آرسنيك بر روي معده و روده نيز ديده كه از علائم آن سوزش لب ها ، بلع همراه با درد ، تشنگي و قولنج ، تهوع و اسهال مي باشد .
در ادامه باعث كم خوني و كاهش گلبول سفيد و مهار سنتز گلبول هاي قرمز ايجاد مي شود و مقادير بالاي آرسنيك موجب ضعف در مغز استخوان مي شود .
هم چنين تحقيقات نشان مي دهد كه ميان آرسنيك و ابتلا به ديابت ارتباط مستقيمي وجود دارد.
آنا ناواس آسين از دانشكده بهداشت عمومي جانز هاپكينز بلومبرگ در بالتيمور و همكارانش ۷۸۸ فرد بالاي ۲۰سال را بررسي كردند. مقدار آرسنيك در ادرار اين افراد آزمايش شد.
محققان دريافتند ۷/۷درصد از شركتكنندگان به ديابت نوع دوم مبتلا هستند كه پس از در نظر گرفتن ساير عوامل خطر در بروز ديابت مشخص شد كه ميزان آرسنيك در ادرار اين افراد ۲۶درصد بيشتر از افراد غيرمبتلا به ديابت است .
اين مطالعات نشان داد بيش از 20 درصد از شركت كنندگاني كه بالاترين ميزان آرسنيك ( 5/16 ميكروگرم در ليتر ) را در ادرار خود داشتند 6/3 درصد بيش از كساني كه كمترين ميزان آرسنيك ( 3 ميكرو گرم در ليتر ) در ادرارشان داشتند به ديابت نوع دوم مبتلا شدند .
محققان به اين نتيجه رسيدند كه آرسنيك ميتواند بر عوامل ژنتيكي كه در حساسيت انسولين و ساير فرايندها دخالت دارد تاثير بگذارد و يا در آسيب سلولي مرتبط با اكسيژن ، التهاب و مرگ سلولي نيز كه با ديابت مرتبط است، نقش داشته باشد .
* در مواردي نيز این عنصر مخوف به تداوم زندگي انسان مدد نموده كه از جمله آنهامي توان به التيام زخم ها ، درمان طاعون ، سرطان خون حاد ، مالاريا ، سيفليس ، تريپانوزوميازيس و بيماري رماتيسمي اشاره نمود .
راههای ورود به بدن
آرسنيت 3 ظرفيتي و آرسنات 5 ظرفيتي در آب آشاميدني بيشتر يافت مي شود. مسموميت آب آرسنيك مي توان در اثر گذر آب از صخره هاي غني از آرسنيك و يا آرسنيك موجود در قشر خاك بستر آب رودخانه ها و يا ورود فاضلاب هاي صنعتي به رودخانه ها حاصل مي شود .
اين آب آلوده توسط گياهان و جانوران يا به طور مستقيم توسط خود انسان مصرف مي شود و وارد چرخه غذايي انسان شده و سلامت آن را به مخاطره مي اندازد.
به طور مثال بيماري كبدي شايع در ماهيگيران ژاپني كه به علت مصرف ماهي هاي آلوده به آرسنيك بوجود آمده است .
اندازه گیری ارسنیک
اندازه گيري آرسنيك موجود در آب به روش هاي مختلفي صورت مي گيرد ، اهم اين روش ها استفاده از دستگاه جذب اتمي بصورت هيدريد ، استفاده از روش يدومتري بوسيله نقره در اتيل دي يتو كاربامات به روش اسپكترو فتو متري مي باشد . در صورتي كه مقدار آرسنيك موجود در آب بيشتر از حد استاندارد بود مي توان از طريق آهك زني و ته نشيني الكتريكي اسمز معكوس و تعويض يون مقدار اضافي را حذف نمود .
روشهای حذف ارسنیک
از روش هاي اميد بخشي كه ميتوان به راحتي آرسنيك را از آب جدا نمود و آن را به آب سالم تبديل كرد استفاده از بلورهاي نازك زنگ آهن است .
ذرات اكسيد آهن مي توانند به مقدار زياد با آرسنيك موجود در آب پيوند برقرار نمايند
از ديگر روش ها حذف آرسنيك با استفاده از آلوميناي فعال اصلاح شده با تركيبات آهني مي باشد كه اين آلومينا محصول آلكان كانادا با نام تجاري 50AAFS- است.
آزمايشهاي تعادلي در حالت منقطع با استفاده از همزن انجام گرفت و آرسينيك به روش SDDC آناليز شد .
آخرین ویرایش:
سرب
سرب
برای نوشیدن یا آشپزی از آب سرد استفاده کنید ،زیرا آب گرم درصد بیشتری سرب دارد.
سطوح مختلف را با موادی اختصاصا زدودن سرب استفاده میشود نظیر تری سدیم فسفات یا پودرهای مخصوص ماشین ظرفشویی شست و شو دهید.
چوبهای رنگ شده را هرگز سمباده نزنید و یا نسوزانید.
قوطی های کنسرو استفاده شده را مجددا برای نگهداری مواد غذایی استفاده نکنید.
سرب
خواص فيزيكي سرب
سرب خالص داراي خواص زير مي باشد :
| وزن اتمي عدد اتمي نقطه ذوب نقطه جوش وزن مخصوص هدايت الكتريكي سختي رنگ شبكه كريستالي | 9/207 82 5/327 1744 35/11 گرم بر سانتي متر مكعب در 20 98/7 (اگر در صفر درجه سانتي گراد براي مس 100 در نظر بگيريم) Mohs5/1 آبي خاكستري مكعبي با سطوح مركز دار (F.C.C) |
موارد كاربرد سرب :
بعلت وزن مخصوص و جرم اتمي بالا در كاربردهاي هسته اي بمنظور حفاظت در مقابل اشعه گاما مورد استفاده قرارميگيرد.
سرب و تركيبات آن در موارد زير كاربرد وسيعي دارد.
وسايل صنايع دفاعي ، غلاف پوششهاي كابل ،ورق ها ، پروفيلها ، ياتاقانسازي ، پوشش هاي اسپري (گالوانيزاسيون) ، لوله هاي نرم لحيم كاري، صنعت چاپ و نوار و سيم ، باتريسازي ، صنايع چوب، صنايع نفت و پتروشيمي ، كبريت سازي، لعاب كاري و رنگ سازي ، ساختن مخازن اسيد سولفوريك گرم و غليظ ‚ چيت سازي ، ريخته گري قطعات
آسیب های سرب
سرب راههای زیادی برای کشتن انسان دارد.
1) مهمترین این راهها وارد شدن در ترکیب گلوله اسلحه است.
2) استفاده از لولههای آب سربدار
3)تنفس هوای آلوده توسط کارکنان معادن سرب، کارکنان کارخانههای باطری سازی و نظایر آن که در معرض تماس با سرب هستند.و حتی شهروندانی که در شهرهای صنعتی و آلوده زندگی میکنند.
به طور کلی مسمومیت با سرب یکی از عوامل ایجاد کننده کم خونی، پوکی استخوان و ایجاد ضعف عمومی و خستگی مزمن در بزرگسالان است.
سرب میتواند باعث ایجاد اختلالات گوارشی چون دردهای شکمی شود. بسیاری از اوقات تجمع سرب با درد آپاندیسیت اشتباه گرفته میشود.
نشانههای مسمومیت با سرب در کودکان کمی متفاوتتر است. وجود خطوط کدر بر روی دندانها، تغییرات رفتاری و کاهش رشد ذهنی در اثر تماس کودکان با سرب ایجاد میشود. علامتهایی چون تجمع سرب در استخوانها، تجمع سرب در گلبولهای قرمز، خستگی مزمن، پیری زودرس، سردرد، افسردگی، پوکی استخوان زودرس، تغییرات روحی و رفتاری چون عصبانیت و پرخاشگری نیز اغلب در میان بزرگسالان شایع است.
اقدامات حفاظتی
این ماده جامد شدیدا سمی (احتمال ایجاد سرطان ،خطرات تناسلی ،تراتوژن موتاژن را دارد.)میباشد.
قبل از جابجایی ،اقدامات کنترل مهندسی برای حفاظت اپراتور بسیار مهم است.افراد باید مجهز به کلیه لوازم حفاظت فردی مورد نیاز باشند.و افراد باید اموزش لازم را در ارتباط با نحوه انجام کار و خطرات کار با این ماده را ببینند.
راه های تشخیص
مسمومیت با سرب با ازمایش خون مشخص میشود ، که به علت اینکه علائم خاصی ندارد جز ازمایشات روتین خون محسوب نمیشود.
سرب و تركيبات آن در موارد زير كاربرد وسيعي دارد.
وسايل صنايع دفاعي ، غلاف پوششهاي كابل ،ورق ها ، پروفيلها ، ياتاقانسازي ، پوشش هاي اسپري (گالوانيزاسيون) ، لوله هاي نرم لحيم كاري، صنعت چاپ و نوار و سيم ، باتريسازي ، صنايع چوب، صنايع نفت و پتروشيمي ، كبريت سازي، لعاب كاري و رنگ سازي ، ساختن مخازن اسيد سولفوريك گرم و غليظ ‚ چيت سازي ، ريخته گري قطعات
آسیب های سرب
سرب راههای زیادی برای کشتن انسان دارد.
1) مهمترین این راهها وارد شدن در ترکیب گلوله اسلحه است.
2) استفاده از لولههای آب سربدار
3)تنفس هوای آلوده توسط کارکنان معادن سرب، کارکنان کارخانههای باطری سازی و نظایر آن که در معرض تماس با سرب هستند.و حتی شهروندانی که در شهرهای صنعتی و آلوده زندگی میکنند.
به طور کلی مسمومیت با سرب یکی از عوامل ایجاد کننده کم خونی، پوکی استخوان و ایجاد ضعف عمومی و خستگی مزمن در بزرگسالان است.
سرب میتواند باعث ایجاد اختلالات گوارشی چون دردهای شکمی شود. بسیاری از اوقات تجمع سرب با درد آپاندیسیت اشتباه گرفته میشود.
نشانههای مسمومیت با سرب در کودکان کمی متفاوتتر است. وجود خطوط کدر بر روی دندانها، تغییرات رفتاری و کاهش رشد ذهنی در اثر تماس کودکان با سرب ایجاد میشود. علامتهایی چون تجمع سرب در استخوانها، تجمع سرب در گلبولهای قرمز، خستگی مزمن، پیری زودرس، سردرد، افسردگی، پوکی استخوان زودرس، تغییرات روحی و رفتاری چون عصبانیت و پرخاشگری نیز اغلب در میان بزرگسالان شایع است.
اقدامات حفاظتی
این ماده جامد شدیدا سمی (احتمال ایجاد سرطان ،خطرات تناسلی ،تراتوژن موتاژن را دارد.)میباشد.
قبل از جابجایی ،اقدامات کنترل مهندسی برای حفاظت اپراتور بسیار مهم است.افراد باید مجهز به کلیه لوازم حفاظت فردی مورد نیاز باشند.و افراد باید اموزش لازم را در ارتباط با نحوه انجام کار و خطرات کار با این ماده را ببینند.
راه های تشخیص
مسمومیت با سرب با ازمایش خون مشخص میشود ، که به علت اینکه علائم خاصی ندارد جز ازمایشات روتین خون محسوب نمیشود.
راههای پیشگیری
برای نوشیدن یا آشپزی از آب سرد استفاده کنید ،زیرا آب گرم درصد بیشتری سرب دارد.
سطوح مختلف را با موادی اختصاصا زدودن سرب استفاده میشود نظیر تری سدیم فسفات یا پودرهای مخصوص ماشین ظرفشویی شست و شو دهید.
چوبهای رنگ شده را هرگز سمباده نزنید و یا نسوزانید.
قوطی های کنسرو استفاده شده را مجددا برای نگهداری مواد غذایی استفاده نکنید.
جذب پوستی بیسفنول A
جذب پوستی بیسفنول A
جذب پوستی بیسفنول A
محققان برای اینكه متوجه شوند آیا بیسفنول A از طریق پوست نیز قابل جذب است یا خیر آن را روی گوش خوك آزمایش كردند و متوجه شدند نیمی از بیسفنول A در مواجهه با پوست جذب میشود. بعد از برشهای كوچك پوست انسان برای آزمایش استفاده كردند و متوجه شدند 40 درصد از مولكولهای بیسفنول A میتواند از پوست بگذرد. سرعت عبور آن نیز بسیار بالاست. مواجهه 2 ساعته مواجهه پوست با بیسفنول A باعث میشود طی 24 ساعت آتی همچنان بیسفنول A از طریق پوست وارد خون شود. همچنین نتایج بررسیهای محققان آمریكایی نیز نشان داد میزان بیسفنول A در خون افرادی كه به طور مرتب با رسیدهای صندوق در تماس هستند مانند مسوول صندوق بسیار بالاست.
 چطور بیسفنول A از طریق پوست جذب میشود؟
چطور بیسفنول A از طریق پوست جذب میشود؟
نگاهی دقیقتر به این تركیب شیمیایی میاندازیم. بیسفنول A به 2 صورت پلیمریزه میشود؛ از یك سو از آن پلیكربنات تهیه میكنند كه در بسیاری از بطریهای آب و شیشههای پلاستیكی شیر كاربرد دارد. پلیكربناتها وقتی گرم میشوند، پلیمر آزاد میكنند و همین جنبه از آنها مضر است. از بیسفنول A در تولید نوعی رزین به نام آپوكسی هم استفاده میشود كه در داخل قوطیهای نوشیدنی و كنسروها وجود دارد و در واقع، باعث میشود داخل دیواره كنسرو یك لایه به رنگ لاك سفید ببینید. امكان اینكه پلیمرهای این رزین شكسته و وارد غذا شوند نیز بسیار بالاست. در مورد رسیدهای چاپی باید گفت روی این برگهها پودری وجود دارد كه یكهزارم وزن كل كاغذ را دارد و از بیسفنول A آزاد یعنی غیر پلیمریزه تهیه شده و برخلاف بیسفنول A موجود در بستهبندی مواد غذایی به محض تماس با دست جذب میشود. در واقع، ما در تمام روز با دوز پایین بیسفنول A در تماس هستیم و در حال حاضر محققان به دنبال یافتن این موضوعاند كه مواجهه دایمی با بیسفنول A در طولانیمدت میتواند سبب بروز چه مشكلاتی شود. تحقیقات پیشین نشان داده بود كه بیسفنول A اگر از طریق غذا وارد بدن شود میتواند مشكلاتی نظیر سرطان دستگاه گوارش و اختلال كاركرد غدد درونریز را پیش آورد. 2 تحقیق اخیر نیز نشان داده است كه بیسفنول A میتواند بر باروری مردان تاثیرگذار باشد. در اولین تحقیق، 514 كارگر چینی به مدت 5 سال زیر نظر گرفته شدند. نتایج بررسیها نشان داد كسانی كه در ادرارشان بیسفنول A بیشتری وجود دارد، كیفیت اسپرم پایینتریدارند. به هر حال توصیه میشود تا جای ممكن از دست زدن به این نوع رسیدها خودداری كنید.

این ماده پس از رسیدن به بدن جذب شده و مانند یک هورمون به سرعت به سلولهای هدف میرسد و اثر مخرب خود را میگذارد. از لحاظ علم شیمی نیز با دارا بودن دو حلقه ی بنزنی آروماتیک است و با اطلاع از مضرات ترکیبات آروماتیک متوجه می شویم که تا چه حد خطرناک است و در حقیقت تمام کاربران خدمات الکترونیکی کارت های بانکی و بسیاری از مصرف کننده های موادی که در قسمت قبل ذکر شد مثل کنسروها در معرض این ماده ی خطرناک قرار دارند بطوریکه کمتر کسی متوجه حضور آن است.
جذب پوستی بیسفنول A
جذب پوستی بیسفنول A
محققان برای اینكه متوجه شوند آیا بیسفنول A از طریق پوست نیز قابل جذب است یا خیر آن را روی گوش خوك آزمایش كردند و متوجه شدند نیمی از بیسفنول A در مواجهه با پوست جذب میشود. بعد از برشهای كوچك پوست انسان برای آزمایش استفاده كردند و متوجه شدند 40 درصد از مولكولهای بیسفنول A میتواند از پوست بگذرد. سرعت عبور آن نیز بسیار بالاست. مواجهه 2 ساعته مواجهه پوست با بیسفنول A باعث میشود طی 24 ساعت آتی همچنان بیسفنول A از طریق پوست وارد خون شود. همچنین نتایج بررسیهای محققان آمریكایی نیز نشان داد میزان بیسفنول A در خون افرادی كه به طور مرتب با رسیدهای صندوق در تماس هستند مانند مسوول صندوق بسیار بالاست.

نگاهی دقیقتر به این تركیب شیمیایی میاندازیم. بیسفنول A به 2 صورت پلیمریزه میشود؛ از یك سو از آن پلیكربنات تهیه میكنند كه در بسیاری از بطریهای آب و شیشههای پلاستیكی شیر كاربرد دارد. پلیكربناتها وقتی گرم میشوند، پلیمر آزاد میكنند و همین جنبه از آنها مضر است. از بیسفنول A در تولید نوعی رزین به نام آپوكسی هم استفاده میشود كه در داخل قوطیهای نوشیدنی و كنسروها وجود دارد و در واقع، باعث میشود داخل دیواره كنسرو یك لایه به رنگ لاك سفید ببینید. امكان اینكه پلیمرهای این رزین شكسته و وارد غذا شوند نیز بسیار بالاست. در مورد رسیدهای چاپی باید گفت روی این برگهها پودری وجود دارد كه یكهزارم وزن كل كاغذ را دارد و از بیسفنول A آزاد یعنی غیر پلیمریزه تهیه شده و برخلاف بیسفنول A موجود در بستهبندی مواد غذایی به محض تماس با دست جذب میشود. در واقع، ما در تمام روز با دوز پایین بیسفنول A در تماس هستیم و در حال حاضر محققان به دنبال یافتن این موضوعاند كه مواجهه دایمی با بیسفنول A در طولانیمدت میتواند سبب بروز چه مشكلاتی شود. تحقیقات پیشین نشان داده بود كه بیسفنول A اگر از طریق غذا وارد بدن شود میتواند مشكلاتی نظیر سرطان دستگاه گوارش و اختلال كاركرد غدد درونریز را پیش آورد. 2 تحقیق اخیر نیز نشان داده است كه بیسفنول A میتواند بر باروری مردان تاثیرگذار باشد. در اولین تحقیق، 514 كارگر چینی به مدت 5 سال زیر نظر گرفته شدند. نتایج بررسیها نشان داد كسانی كه در ادرارشان بیسفنول A بیشتری وجود دارد، كیفیت اسپرم پایینتریدارند. به هر حال توصیه میشود تا جای ممكن از دست زدن به این نوع رسیدها خودداری كنید.

این ماده پس از رسیدن به بدن جذب شده و مانند یک هورمون به سرعت به سلولهای هدف میرسد و اثر مخرب خود را میگذارد. از لحاظ علم شیمی نیز با دارا بودن دو حلقه ی بنزنی آروماتیک است و با اطلاع از مضرات ترکیبات آروماتیک متوجه می شویم که تا چه حد خطرناک است و در حقیقت تمام کاربران خدمات الکترونیکی کارت های بانکی و بسیاری از مصرف کننده های موادی که در قسمت قبل ذکر شد مثل کنسروها در معرض این ماده ی خطرناک قرار دارند بطوریکه کمتر کسی متوجه حضور آن است.
Elham fs2011
عضو جدید
با سلام
من حد استاندارد فلزات کادمیوم،نیکل،مس،قلع،روی،کروم،سرب،آهن را در پنیر(در صورت وجود استاندارد) و در صورت نبود آن در پنیر در فرآورده های لبنی ویا مواد غذایی در اتحادیه اروپا، کدکس و ایران را میخواستم. ممنون
من حد استاندارد فلزات کادمیوم،نیکل،مس،قلع،روی،کروم،سرب،آهن را در پنیر(در صورت وجود استاندارد) و در صورت نبود آن در پنیر در فرآورده های لبنی ویا مواد غذایی در اتحادیه اروپا، کدکس و ایران را میخواستم. ممنون
fa7alveh
کاربر ممتاز تالار شیمی
با سلام
من حد استاندارد فلزات کادمیوم،نیکل،مس،قلع،روی،کروم،سرب،آهن را در پنیر(در صورت وجود استاندارد) و در صورت نبود آن در پنیر در فرآورده های لبنی ویا مواد غذایی در اتحادیه اروپا، کدکس و ایران را میخواستم. ممنون
سلام
دوست گلم درخواست استانداردتون را می تونید توی تالار مقالات علمی و پسوردهای دانشگاهی قسمت مقالات لاتین یه تاپیک برای درخواست استاندارد هست.
fa7alveh
کاربر ممتاز تالار شیمی
**سم شناسی متانول و تولوئن **
**سم شناسی متانول و تولوئن **

متانول :
متانول ساده یک الکل یک ظرفیتی و سادهترین و سبکترین نوع الکل است که بر اساس اسناد علمی اگر کسی این نوع الکل را به شکل مایع اشتباهی به صورت خوراکی مصرف کند،قطعاً کور میشود.
حتی اگر میزان کمی از این الکل در حد 50 سی سی نیز به صورت مایع خورده شود، باز هم کوری ناشی از مصرف آن قطعی است.
مکانیزم این مسئله به این شکل است که بعد از سوخت و ساز و متابولیسم این نوع الکل در بدن به مادهای به نام فرمالدئید در بدن تولید میشود که سیستم عصبی شبکیه چشم به این ماده بسیار حساس است و با ورود این ماده در بدن کوری رخ میدهد.
پرفسور بلالیمود هشدار داد : حتی میزان بسیار کم متانول یا همان الکل صنعتی در حد یک قاشق غذاخوری برای یک کودک و یا 100میلی لیتر برای بزرگسال ، خون را به شدت اسیدی می کند و منجر به مسمومیت شدید می شود و گاه ممکن است فرد را به اغما برده و حتی موجب مرگش شود.
متانول یا الکل چوب با وزن مولکولی 32 در صورت خالص بودن بیرنگ و بی بوست و در ضدیخ، جلادهنده ها ، حلالهای رنگ و لاک و نیز رنگ برها استفاده می شود. از آن برای ایجاد گرما (سوختن) در چراغهای الکلی در مشاغل مختلف نیز استفاده می گردد.
نوع مسمومیت: اکثر مسمومیتهای اتفاق افتاده با متانول تصادفی و اتفاقی بوده و درصد اندکی از آن به قصد خودکشی می باشد. (میزان قابل توجهی از مسمومیتهای گزارش شده از سوء مصرف متانول به جای اتانول یا همان الکل سفید در افراد ناآگاه می باشد)
اطلاعات فارماکوکینتیکی: ماکزیمم غلظت سرمی آن 30 تا 60 دقیقه پس از خوردن حاصل شده اما اثرات توکسیک آن معمولا در 12 الی 24 ساعت بعد ظاهر می شود. نیمه عمر آن 8 ساعت و در صورا استفاده از آنتی دوت اتانول بین 30 تا 35 ساعت می باشد. در صورت استفاده از همودیالیز نیمه عمر به 2/5 ساعت می رسد.
مکانیسم سمیت: عامل اصلی اثرات توکسیک متانول متابلیتهای حاصل از متابلیسم آن توسط ADH یا آنتی دیورتیک هورمون می باشد. متانول دو متابولیت سمی مهم دارد : فرمالدئید و فرمات (اسید فرمیک) که این دو عامل اصلی اثرات سمی متانول هستند. که باعث نکروز هسته پوتامن ،دمیلیناسیون و ایجاد اسکوتوما و نیز باعث ایجاد اسیدوز می شوند.
مقادیر توکسیک: مصرف بیش از 4 میلی لیتر از محلول 100٪ آن باعث مسمومیت می گردد. دز کشنده آن در افراد مختلف متفاوت است مثلا مصرف 6 میلی لیتر از محلول 100٪ متانول نیز کشنده بوده است.
علائم و نشانه ها:
اختلال بینایی و اسیدور دو علامت اصلی هستند و علت عمده مرگ اسیدوز و نارسایی تنفسی است.
چشم: تاری دید، اسکوتومای مرکزی، پرخونی اپتیک (اولین یافته در معاینات افتالموسکوپیک)، ادم مردمک، گشاد شدن مردمک بدون واکنش و در نهایت کوری . نقص بینایی اگر ظرف یک هفته اول بهبود نیابد بعد از آن تقریبا تا آخر عمر باقی خواهد ماند.
دستگاه عصبی مرکزی: سردرد، سرگیجه، گیجی و منگی، تشنج، کما
دستگاه گوارشی: تهوع، استفراغ، درد شکم و پانکراتیت
دستگاه تنفس: تاکیپنه و هیپرپنه
تدابیر درمانی:
تجویز اکسیژن و IV line
لاواژ (شستشوی معده) با 2 الی 4 میلی لیتر آب نیم گرم که در هر لیتر آن یک قاشق چایخوری بیکربنات سدیم باشد
تجویز اتانول (اتانول آنتی دوت متانول می باشد. اتانول و متانول هر دو توسط هورمون ضد ادرار یا آنتی دیورتیک هورمون ADH متابلیزه می شوند اما تمایل یا affinity هورمون به اتانول 10 الی 20 برابر بیشتر از تمایل آن به متانول است پس به جای متانول اتانول متابلیزه می گردد و متابلیتهای سمی متانول کمتر ایجاد می گردند تا فرصت برای دفع متانول دست نخورده (از راه همودیالیز) در اختیار قرار گیرد.)
اصلاح اسیدوز با تجویز اسید کربنیک HCO3
تجویز اسیدفولیک
انجام همودیالیز
همودیالیز بر اساس پروتکل درمانی در این موارد توصیه می گردد:
الف - غلظت سرمی بالای 20 mg/dl متانول
ب - مصرف بیش از 30 میلی لیتر از متانول
ج - مشکلات دید و وجود علائم چشمی
د - عدم پیشرفت در کنترل و کم کردن اسیدوز با انفوزیون بی کربنات
7. تجویز مسهل در شرایط کنترل شده هم توصیه شده است.
تولوئن :

از هیدروکربنهای آروماتیک است و به مقدار زیادی در قطران زغال سنگ یافت میشود.
مایعی بیرنگ و آتشگیری است و به عنوان حلال در صنایع مختلفی چون رنگ و رزین کاربرد دارد. فرمول شیمیایی آن C6H5CH۳ میباشد و از واکنش یدید متیل ( CH3I ) با بنزن و آلومینیوم کلراید (AlCl3 ) میتوان آن را در شرایط آزمایشگاهی تولید کرد.
روش تولید تولوئن در شرایط آزمایشگاهی به طور خلاصه به شرح زیر است:
در داخل یک لوله آزمایش بزرگ و مقاوم ، ۲ml از مایع بنزن را با چند قطره از یدید متیل ( CH3I ) و ۰٫۴ گرم آلومینیوم کلراید (AlCl3 ) پودری شکل به آرامی حرارت دهید تا هنگامی که کاغذ تورنسل مرطوب شده در بالای لوله آزمایش، از رنگ آبی به سرخ تبدیل شده و پایان واکنش را مشخص نماید.
بااکسایش تولوئن توسط یک اکسنده قوی نظیر پرمنگنات پتاسیم میتوانیم به یکی از مشتقات تولوئن(بنزن) به نام بنزوئیک اسید دست یافت .
بنزوئیک اسید جامدی سفید رنگ با بلورهای سوزنی شکل است که خاصیت ضد کپک داشته و به همین دلیل در صنعت سوسیس و کالباس سازی از آن استفاده میشود. کلیه مشتقات بنزن کم و بیش سرطانزا هستند.
تولوئن (متیلبنزن یا فنیلمتان)، مایعی صاف و نامحلول در آب با بویی شبیه بوی تینرهای رنگ معمولی است. تولوئن از گروه ترکیبات آروماتیک است و به عنوان یک مادهٔ اولیه و همچنین حلال شیمیایی کاربرد دارد.
کاربردهای دیگر آن عبارتست از :
حلال رنگ، تینر رنگ، درزگیر سیلیکونی، واکنشگر شیمیایی، پلاستیک، جوهر چاپ، چسب، لاک و ضدعفونی کننده و گندزدا. همچنین میتوان از آن برای ساخت فوم و TNT استفاده نمود.

نکته جالب دو مورد تولوئن کاربرد آن به عنوان دارویی استنشاقی برای زدودن سموم میباشد. سمیت تولوئن در مقایسه با بنزن بسیار کمتر است.
هرچند غلظت بسیار بالایی لازم است تا تنفس تولوئن منجر به مرگ شود، اما غلظتهای کمتر آن به راحتی بر روی سیستم عصبی تأثیر میگذارند. غلظتهای کم تا متوسط تولوئن، سب خستگی، سرگیجه، ضعف، رفتار نامتعادل، نقصان حافظه، بیخوابی، کماشتهایی، و کم شدن دید و شنوایی میگردد.
این حالات با از بین رفتن حضور تولوئن، کم میشوند. تولوئن ممکن است بر کلیه اثر نامطلوب بگذارد .
هیچ مدرکی دال بر سرطانزا بودن تولوئن در دست نیست.
غلظت مجاز ppm۲۰۰ برای محیط کار توسط OSHA و mg/l۱ توسط EPA برای آب آشامیدنی توصیه شدهاند.
تولوئن نه تنها از طریق استنشاق بخارش میتواند به بدن انسان وارد شود، بلکه از خاکهای آلوده شده هم این امکان وجود دارد؛ چرا که در این حالت، امکان تماس مستقیم انسان با خاک، نوشیدن آب زیرزمینی آلوده و تبخیر از خاک وجود دارد. با توجه به سرطانزا بودن بنزن، هم اکنون از تولوئن که خواصی شبیه به بنزن دارد، به عنوان جانشین استفاده میشود.
**سم شناسی متانول و تولوئن **

متانول ساده یک الکل یک ظرفیتی و سادهترین و سبکترین نوع الکل است که بر اساس اسناد علمی اگر کسی این نوع الکل را به شکل مایع اشتباهی به صورت خوراکی مصرف کند،قطعاً کور میشود.
حتی اگر میزان کمی از این الکل در حد 50 سی سی نیز به صورت مایع خورده شود، باز هم کوری ناشی از مصرف آن قطعی است.
مکانیزم این مسئله به این شکل است که بعد از سوخت و ساز و متابولیسم این نوع الکل در بدن به مادهای به نام فرمالدئید در بدن تولید میشود که سیستم عصبی شبکیه چشم به این ماده بسیار حساس است و با ورود این ماده در بدن کوری رخ میدهد.
پرفسور بلالیمود هشدار داد : حتی میزان بسیار کم متانول یا همان الکل صنعتی در حد یک قاشق غذاخوری برای یک کودک و یا 100میلی لیتر برای بزرگسال ، خون را به شدت اسیدی می کند و منجر به مسمومیت شدید می شود و گاه ممکن است فرد را به اغما برده و حتی موجب مرگش شود.
متانول یا الکل چوب با وزن مولکولی 32 در صورت خالص بودن بیرنگ و بی بوست و در ضدیخ، جلادهنده ها ، حلالهای رنگ و لاک و نیز رنگ برها استفاده می شود. از آن برای ایجاد گرما (سوختن) در چراغهای الکلی در مشاغل مختلف نیز استفاده می گردد.
نوع مسمومیت: اکثر مسمومیتهای اتفاق افتاده با متانول تصادفی و اتفاقی بوده و درصد اندکی از آن به قصد خودکشی می باشد. (میزان قابل توجهی از مسمومیتهای گزارش شده از سوء مصرف متانول به جای اتانول یا همان الکل سفید در افراد ناآگاه می باشد)
اطلاعات فارماکوکینتیکی: ماکزیمم غلظت سرمی آن 30 تا 60 دقیقه پس از خوردن حاصل شده اما اثرات توکسیک آن معمولا در 12 الی 24 ساعت بعد ظاهر می شود. نیمه عمر آن 8 ساعت و در صورا استفاده از آنتی دوت اتانول بین 30 تا 35 ساعت می باشد. در صورت استفاده از همودیالیز نیمه عمر به 2/5 ساعت می رسد.
مکانیسم سمیت: عامل اصلی اثرات توکسیک متانول متابلیتهای حاصل از متابلیسم آن توسط ADH یا آنتی دیورتیک هورمون می باشد. متانول دو متابولیت سمی مهم دارد : فرمالدئید و فرمات (اسید فرمیک) که این دو عامل اصلی اثرات سمی متانول هستند. که باعث نکروز هسته پوتامن ،دمیلیناسیون و ایجاد اسکوتوما و نیز باعث ایجاد اسیدوز می شوند.
مقادیر توکسیک: مصرف بیش از 4 میلی لیتر از محلول 100٪ آن باعث مسمومیت می گردد. دز کشنده آن در افراد مختلف متفاوت است مثلا مصرف 6 میلی لیتر از محلول 100٪ متانول نیز کشنده بوده است.
علائم و نشانه ها:
اختلال بینایی و اسیدور دو علامت اصلی هستند و علت عمده مرگ اسیدوز و نارسایی تنفسی است.
چشم: تاری دید، اسکوتومای مرکزی، پرخونی اپتیک (اولین یافته در معاینات افتالموسکوپیک)، ادم مردمک، گشاد شدن مردمک بدون واکنش و در نهایت کوری . نقص بینایی اگر ظرف یک هفته اول بهبود نیابد بعد از آن تقریبا تا آخر عمر باقی خواهد ماند.
دستگاه عصبی مرکزی: سردرد، سرگیجه، گیجی و منگی، تشنج، کما
دستگاه گوارشی: تهوع، استفراغ، درد شکم و پانکراتیت
دستگاه تنفس: تاکیپنه و هیپرپنه
تدابیر درمانی:
تجویز اکسیژن و IV line
لاواژ (شستشوی معده) با 2 الی 4 میلی لیتر آب نیم گرم که در هر لیتر آن یک قاشق چایخوری بیکربنات سدیم باشد
تجویز اتانول (اتانول آنتی دوت متانول می باشد. اتانول و متانول هر دو توسط هورمون ضد ادرار یا آنتی دیورتیک هورمون ADH متابلیزه می شوند اما تمایل یا affinity هورمون به اتانول 10 الی 20 برابر بیشتر از تمایل آن به متانول است پس به جای متانول اتانول متابلیزه می گردد و متابلیتهای سمی متانول کمتر ایجاد می گردند تا فرصت برای دفع متانول دست نخورده (از راه همودیالیز) در اختیار قرار گیرد.)
اصلاح اسیدوز با تجویز اسید کربنیک HCO3
تجویز اسیدفولیک
انجام همودیالیز
همودیالیز بر اساس پروتکل درمانی در این موارد توصیه می گردد:
الف - غلظت سرمی بالای 20 mg/dl متانول
ب - مصرف بیش از 30 میلی لیتر از متانول
ج - مشکلات دید و وجود علائم چشمی
د - عدم پیشرفت در کنترل و کم کردن اسیدوز با انفوزیون بی کربنات
7. تجویز مسهل در شرایط کنترل شده هم توصیه شده است.
تولوئن :

از هیدروکربنهای آروماتیک است و به مقدار زیادی در قطران زغال سنگ یافت میشود.
مایعی بیرنگ و آتشگیری است و به عنوان حلال در صنایع مختلفی چون رنگ و رزین کاربرد دارد. فرمول شیمیایی آن C6H5CH۳ میباشد و از واکنش یدید متیل ( CH3I ) با بنزن و آلومینیوم کلراید (AlCl3 ) میتوان آن را در شرایط آزمایشگاهی تولید کرد.
روش تولید تولوئن در شرایط آزمایشگاهی به طور خلاصه به شرح زیر است:
در داخل یک لوله آزمایش بزرگ و مقاوم ، ۲ml از مایع بنزن را با چند قطره از یدید متیل ( CH3I ) و ۰٫۴ گرم آلومینیوم کلراید (AlCl3 ) پودری شکل به آرامی حرارت دهید تا هنگامی که کاغذ تورنسل مرطوب شده در بالای لوله آزمایش، از رنگ آبی به سرخ تبدیل شده و پایان واکنش را مشخص نماید.
بااکسایش تولوئن توسط یک اکسنده قوی نظیر پرمنگنات پتاسیم میتوانیم به یکی از مشتقات تولوئن(بنزن) به نام بنزوئیک اسید دست یافت .
بنزوئیک اسید جامدی سفید رنگ با بلورهای سوزنی شکل است که خاصیت ضد کپک داشته و به همین دلیل در صنعت سوسیس و کالباس سازی از آن استفاده میشود. کلیه مشتقات بنزن کم و بیش سرطانزا هستند.
تولوئن (متیلبنزن یا فنیلمتان)، مایعی صاف و نامحلول در آب با بویی شبیه بوی تینرهای رنگ معمولی است. تولوئن از گروه ترکیبات آروماتیک است و به عنوان یک مادهٔ اولیه و همچنین حلال شیمیایی کاربرد دارد.
کاربردهای دیگر آن عبارتست از :
حلال رنگ، تینر رنگ، درزگیر سیلیکونی، واکنشگر شیمیایی، پلاستیک، جوهر چاپ، چسب، لاک و ضدعفونی کننده و گندزدا. همچنین میتوان از آن برای ساخت فوم و TNT استفاده نمود.

هرچند غلظت بسیار بالایی لازم است تا تنفس تولوئن منجر به مرگ شود، اما غلظتهای کمتر آن به راحتی بر روی سیستم عصبی تأثیر میگذارند. غلظتهای کم تا متوسط تولوئن، سب خستگی، سرگیجه، ضعف، رفتار نامتعادل، نقصان حافظه، بیخوابی، کماشتهایی، و کم شدن دید و شنوایی میگردد.
این حالات با از بین رفتن حضور تولوئن، کم میشوند. تولوئن ممکن است بر کلیه اثر نامطلوب بگذارد .
هیچ مدرکی دال بر سرطانزا بودن تولوئن در دست نیست.
غلظت مجاز ppm۲۰۰ برای محیط کار توسط OSHA و mg/l۱ توسط EPA برای آب آشامیدنی توصیه شدهاند.
تولوئن نه تنها از طریق استنشاق بخارش میتواند به بدن انسان وارد شود، بلکه از خاکهای آلوده شده هم این امکان وجود دارد؛ چرا که در این حالت، امکان تماس مستقیم انسان با خاک، نوشیدن آب زیرزمینی آلوده و تبخیر از خاک وجود دارد. با توجه به سرطانزا بودن بنزن، هم اکنون از تولوئن که خواصی شبیه به بنزن دارد، به عنوان جانشین استفاده میشود.
Similar threads
| Thread starter | عنوان | تالار | پاسخ ها | تاریخ |
|---|---|---|---|---|
|
|
الکل و الکل شناسی | شیمی | 26 | |
|
|
پليمرها و مواد زيست تخريب پذير در مقايسه با پلاستيك | شیمی | 0 | |
|
|
گران قیمت ترین مواد جهان! | شیمی | 0 |

