سلام خوب هستین من نیاز فوری به مطلب درمورداستانیلید داشتم
اگه ممکنه سریع باشه تئوری ومکانیسم این ماده یعنی تهیه ی استانیلید
ممنون
[FONT=arial, helvetica, sans-serif]استانیلید یا فنیل استامید نرمال یا استانیلین نرمال یک ماده ورقه ای (پرکی شکل) سفید یا کرم رنگ می باشد. این ماده در انواع بی رنگ، کریستالی براق نیز موجود است. از این ماده به عنوان تب بر و ضد درد استفاده می گردد. همچنین استانیلید به عنوان یک ماده میانی در ساخت رنگینه ها نقش حیاتی ایفا می کند.[/FONT]
[FONT=arial, helvetica, sans-serif]خصوصیات[/FONT]
[FONT=arial, helvetica, sans-serif]1)استانیلید یک پودر سفید رنگ یا کرم رنگ یا به صورت ورقه ای می باشد.[/FONT]
[FONT=arial, helvetica, sans-serif]2)وزن مولکولی آن برابر 16/135 می باشد.[/FONT]
[FONT=arial, helvetica, sans-serif]3)وزن مخصوص استانیلید 21/1 می باشد.[/FONT]
[FONT=arial, helvetica, sans-serif]4)نقطه ذوب آن 2/114 درجه سانتیگراد می باشد.[/FONT]
[FONT=arial, helvetica, sans-serif]5)نقطه جوش استانیلید 8/303 درجه سانتیگراد می باشد.[/FONT]
[FONT=arial, helvetica, sans-serif]6)در الکل، اتر و بنزن حلالیت دارد.[/FONT]
[FONT=arial, helvetica, sans-serif]7)حلالیت آن در آب ناچیز است.[/FONT]
[FONT=arial, helvetica, sans-serif]8) در دمای 545 درجه سانتی گراد اشتعال پذیر است.[/FONT]
[FONT=arial, helvetica, sans-serif]کاربرد و موارد مصرف[/FONT]
[FONT=arial, helvetica, sans-serif]استانیلید به صورت گسترده به عنوان تب بر و ضد درد استفاده می شود.مصارف اصلی استانیلید به صورت زیر می باشد.[/FONT]
[FONT=arial, helvetica, sans-serif]1)داروئی[/FONT]
[FONT=arial, helvetica, sans-serif]2)مواد میانی و ساخت رنگهای نساجی[/FONT]
[FONT=arial, helvetica, sans-serif]3)به عنوان تسریع کننده در صنایع لاستیک سازی[/FONT]
[FONT=arial, helvetica, sans-serif]4)پایدار کننده پراسید[/FONT]
[FONT=arial, helvetica, sans-serif]5) به عنوان بازدارنده در هیدروژن پراکسید[/FONT]
[FONT=arial, helvetica, sans-serif]6) پایدار کننده استر،سلولوز، روغن جلا[/FONT]
[FONT=arial, helvetica, sans-serif]انواع[/FONT]
[FONT=arial, helvetica, sans-serif]1)صنعتی[/FONT]
[FONT=arial, helvetica, sans-serif]2)فوق العاده خالص[/FONT]
[FONT=arial, helvetica, sans-serif]بررسی جایگاه صنعتی[/FONT]
[FONT=arial, helvetica, sans-serif]در حال حاضر بین 8 تا 10 سازنده استانیلید در کشور هندوستان وجود دارد که مجموع ظرفیت آنها بالغ بر 2850 تن می باشد. هر چند تولیدات آنها بالغ بر 21000 تن می باشد ولی میزان تقاضای آن حدود 3200 تن تخمین زده می شود.[/FONT]
[FONT=arial, helvetica, sans-serif]روش تولید[/FONT]
[FONT=arial, helvetica, sans-serif]سه روش عمده جهت تولید استانیلید وجود دارد.[/FONT]
[FONT=arial, helvetica, sans-serif]1)از آنیلین و اسید استیک[/FONT]
[FONT=arial, helvetica, sans-serif]فرمول واکنش : (بازده 90 درصد)C6H5 NH2 + CH3 COOH à C6H5 NHCOCH3 + H2O[/FONT]
[FONT=arial, helvetica, sans-serif]آب استانیلید اسید استیک آنیلین[/FONT]
[FONT=arial, helvetica, sans-serif]2) از آنیلین و انیدرید استیک[/FONT]
[FONT=arial, helvetica, sans-serif]فرمول واکنش:2C6H5 NH2 + (CH3 CO)2 O à 2C6H5 NHCOCH3 + H2O[/FONT]
[FONT=arial, helvetica, sans-serif]آب استانیلید انیدرید استیک آنیلین[/FONT]
[FONT=arial, helvetica, sans-serif]3) از انیدرید استیک و فنیل آمونیوم کلراید[/FONT]
[FONT=arial, helvetica, sans-serif]انتي فبرين يا فنيل استاميد.گردي است سفيد وبي بووطعم آن گس ودر آب گرم کمي حل شود(يک قسمت استانيليد در 22 قسمت آب )ودرالکل ومايعات الکلي به خوبي حل گردد.اين مادّه با بول دفع مي شود ورنگ بول راسرخ مايل به قهوه اي مي کند.[/FONT]
[FONT=arial, helvetica, sans-serif]آثار استانيليد: اگر چندين روز متوالي روزي يک گرم تا يک گرم و نيم استانيليد بکار برده شود، در چهره و انتهاي دست و پا سيانوز توليد ميشود. سبب سيانوز تبديل هموگلوبين خون به متهموگلوبين است .در آزمايش خون رنگ سرم تغييري نيافته و تعداد و شکل گلبول هاي قرمز تفاوت بسيار نکرده است . از اين آزمايش چنين نتيجه گرفته ميشود که استانيليد هموگلوبين رادر داخل گلبول ها تبديل به متهموگلوبين کرده و خود گلبول هاي قرمز را منهدم نمي کند و تا هنگامي که گلبولها منهدم نشوند متهموگلوبين بسهولت به حالت اکسي هموگلوبين درمي آيد و بهمين جهت است که سيانوز ناشي از استعمال استانيليد بزودي بهبودي يافته و در صورتي که بيش از ميزان تراپوتيکي (درمان شناسي ) تجويز نشده باشد هميشه بدون هيچگونه خطري رفع شده ، اثري از خود باقي نمي گذارد. استانيليد بمقدار بسيار، علاوه بر سيانوز شديد قلب را فلج ميکند. استانيليد حرارت را بسرعت پائين مي آورد. در اثر ضدّ تب چهل سانتي گرم آن با يک گرم آنتي پيرين برابر است . معمولاً ده تا بيست سانتي گرم آن براي پائين آوردن تب کفايت ميکند. استانيليد به ميزان روزي يک گرم تا يک گرم و نيم مقدار بول را کم ميکند.[/FONT]
[FONT=arial, helvetica, sans-serif]موارد استعمال : با وجودي که سيانوز حاصل ازبکار بردن استانيليد زودگذر و بدون خطر است ، اين دارو بعنوان ضدّ تب مضرّي شناخته شده ، از ضدّ تب آن به ندرت استفاده ميشود. اثر ضددرد اين دارو در درمان حملات دردناک تابس ، نورالژي ، سياتيک ، نورالژي بين ضلعي و نورالژي عصب سه شاخه مورد استفاده است . مقدار استعمال آن 25 سانتي گرم در يک بار و 75 سانتي گرم در بيست وچهار ساعت است . حداکثر ميزان استعمال آن در يک بار سي سانتي گرم و در 24 ساعت 5/1 گرم است . (درمان شناسي تاليف محمدعلي غربي ، به اهتمام علي محمد سپهر ج 1 ص 184 و 185.)[/FONT]
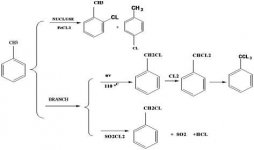
[FONT=arial, helvetica, sans-serif]مشخصات و مکانیزم ساخت نیترواستانیلید[/FONT]
[FONT=arial, helvetica, sans-serif]C6H5-NH(C=O)CH3 استانیلید می باشد که در آن گروه NHCOCH3[/FONT][FONT=arial, helvetica, sans-serif]
بر روی حلقه ی آروماتیکی وجود دارد. حال چنانچه بخواهیم یک گروه دیگر بر روی حلقه قرار دهیم، این گروه می تواند موقعیتهای ارتو، متا و پارا را اشغال نماید. یعنی گروه جدید همسایه ی گروه قبلی باشد (ارتو) و یا یک کربن از آن فاصله داشته باشد(متا) و یا دو کربن فاصله داشته باشد و در دورترین فاصله ی ممکن قرار گیرد (پارا).[/FONT]
[FONT=arial, helvetica, sans-serif]استانیلید دارای نقطه ذوب 113 تا 115 درجه ی سانتیگراد و نقطه جوش 304 درجه ی سانتیگراد می باشد. [/FONT]
[FONT=arial, helvetica, sans-serif]ارتو و پارا نیترواستانیلید بوسیله ی واکنش استانیلید با مخلوطی از نیتریک اسید و سولفوریک اسید بدست می آید. زیرا گروه نخست یعنی [/FONT][FONT=arial, helvetica, sans-serif]NHCOCH3[/FONT][FONT=arial, helvetica, sans-serif] گروه حجیمی است، فرم پارا که در آن دو گروه فوق و نیترو از هم فاصله ی بیشتری دارند، پایدارتر بوده و قسمت بیشتر محصول را به خود اختصاص می دهد. اما جدا کردن ایزومرهای پارا و ارتو از طریق تقطیر جز به جز ممکن است، زیرا ابن دو ترکیب در نقطه ی جوش متفاوت هستند.[/FONT]
[FONT=arial, helvetica, sans-serif]واکنش استانیلید با نیتریک اسید غلیظ سبب تولید پارانیترواستانیلید می شود. برای بالا بردن بازده می توان از نسبت 3 به 1 از سولفوریک اسید و نیتریک اسید استفاده نمود. چون این واکنش گرمازا است، باید افزایش استانیلید به اسید نیتریک غلیظ بسیار آهسته و همراه با سردکردن محیط واکنش صورت گیرد.[/FONT]
[FONT=arial, helvetica, sans-serif]
Acetanilide is a [/FONT]
[FONT=arial, helvetica, sans-serif]prodrug[/FONT][FONT=arial, helvetica, sans-serif]
with [/FONT]
[FONT=arial, helvetica, sans-serif]analgesic[/FONT][FONT=arial, helvetica, sans-serif]
and [/FONT]
[FONT=arial, helvetica, sans-serif]antipyretic[/FONT][FONT=arial, helvetica, sans-serif]
([/FONT]
[FONT=arial, helvetica, sans-serif]fever[/FONT][FONT=arial, helvetica, sans-serif]
-reducing) properties; it is in the same class of drugs as acetaminophen ([/FONT]
[FONT=arial, helvetica, sans-serif]paracetamol[/FONT][FONT=arial, helvetica, sans-serif]
). Under the name acetanilid it formerly figured in the formula of a number of [/FONT]
[FONT=arial, helvetica, sans-serif]patent medicines[/FONT][FONT=arial, helvetica, sans-serif]
and over the counter drugs. In 1948, [/FONT]
[FONT=arial, helvetica, sans-serif]Julius Axelrod[/FONT][FONT=arial, helvetica, sans-serif]
and [/FONT]
[FONT=arial, helvetica, sans-serif]Bernard Brodie[/FONT][FONT=arial, helvetica, sans-serif]
discovered that acetanilide is much more toxic in these applications than other drugs, causing [/FONT]
[FONT=arial, helvetica, sans-serif]methemoglobinemia[/FONT][FONT=arial, helvetica, sans-serif]
and ultimately doing damage to the [/FONT]
[FONT=arial, helvetica, sans-serif]liver[/FONT][FONT=arial, helvetica, sans-serif]
and [/FONT]
[FONT=arial, helvetica, sans-serif]kidneys[/FONT][FONT=arial, helvetica, sans-serif]
. As such, acetanilide has largely been replaced by less toxic drugs, in particular [/FONT]
[FONT=arial, helvetica, sans-serif]acetaminophen[/FONT][FONT=arial, helvetica, sans-serif]
, which is a [/FONT]
[FONT=arial, helvetica, sans-serif]metabolite[/FONT][FONT=arial, helvetica, sans-serif]
of acetanilide and whose use Axelrod and Brodie suggested in the same study.[/FONT]
[FONT=arial, helvetica, sans-serif]
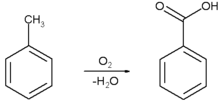
In the 19th century it was one of a large number of compounds used as experimental [/FONT]
[FONT=arial, helvetica, sans-serif]photographic developers[/FONT][FONT=arial, helvetica, sans-serif]
.[/FONT]
[FONT=arial, helvetica, sans-serif]
Acetanilide is commonly used in organic chemistry labs for recrystallization experiments.[/FONT]
[FONT=arial, helvetica, sans-serif]نام:[/FONT]
[FONT=arial, helvetica, sans-serif]استانیلید[/FONT]
[FONT=arial, helvetica, sans-serif]Acetanilide[/FONT]
[FONT=arial, helvetica, sans-serif]نام های مشهور دیگر:[/FONT]
[FONT=arial, helvetica, sans-serif]N - فنیل استامید((N-Phenylacetamide[/FONT]
[FONT=arial, helvetica, sans-serif]Acetanil[/FONT]
[FONT=arial, helvetica, sans-serif]نام تجاری:[/FONT]
[FONT=arial, helvetica, sans-serif]Antifebrin[/FONT]
[FONT=arial, helvetica, sans-serif]شکل مولکول:[/FONT]
[FONT=arial, helvetica, sans-serif]فرمول مولکولی:[/FONT]
[FONT=arial, helvetica, sans-serif]C6H5NH(COCH3)[/FONT]
[FONT=arial, helvetica, sans-serif]جرم مولکولی (گرم بر مول):[/FONT]
[FONT=arial, helvetica, sans-serif]135.17[/FONT]
[FONT=arial, helvetica, sans-serif]نقطه ذوب (درجه سانتیگراد):[/FONT]
[FONT=arial, helvetica, sans-serif]113–114°C (235–239 °F)[/FONT]
[FONT=arial, helvetica, sans-serif]نقطه جوش (درجه سانتی گراد):[/FONT]
[FONT=arial, helvetica, sans-serif]304[/FONT]
[FONT=arial, helvetica, sans-serif]درجه احتراق (درجه سانتیگراد):[/FONT]
[FONT=arial, helvetica, sans-serif]545[/FONT]
[FONT=arial, helvetica, sans-serif]چگالی (گرم بر سانتیمتر مکعب):[/FONT]
[FONT=arial, helvetica, sans-serif]1.219[/FONT]
[FONT=arial, helvetica, sans-serif]حالت:[/FONT]
[FONT=arial, helvetica, sans-serif]جامد- بی بو- بی طعم[/FONT]
[FONT=arial, helvetica, sans-serif]رنگ:[/FONT]
[FONT=arial, helvetica, sans-serif]بدون رنگ مایل به سفید[/FONT]
[FONT=arial, helvetica, sans-serif]حلالیت در آب:[/FONT]
[FONT=arial, helvetica, sans-serif]1 g/185 mL at 22°C[/FONT]
[FONT=arial, helvetica, sans-serif]:[/FONT][FONT=arial, helvetica, sans-serif]CAS number[/FONT]
[FONT=arial, helvetica, sans-serif]103-84-4[/FONT]
[FONT=arial, helvetica, sans-serif]کلیه اطلاعات داده شده در شرایط استاندارد می باشد.[/FONT]
[FONT=arial, helvetica, sans-serif](دمای 25 درجه سانتی گراد و فشار 100 کیلو پاسکال).[/FONT]