You are using an out of date browser. It may not display this or other websites correctly.
You should upgrade or use an alternative browser.
You should upgrade or use an alternative browser.
درباره ایمنی شناسی
- شروع کننده موضوع immunol90
- تاریخ شروع
[h=2]Anti-MCV[/h][FONT=arial, helvetica, sans-serif]یکی از شایع ترین بیماری های اتوایمیون می باشد.خصوصیات اصلی RA التهاب مفاصل است که موجب تخریب مفصل و از دست رفتن کارائی آن می گردد.تشخیص زودهنگام RA و شروع سریع درمان مناسب آن یکی از مهمترین راههای جلوگیری از تخریب کامل مفصلی می باشد.تشخیص Ra اساسا به علائم کلینیکی و آزمایشات سرولوژیک بر علیه آنتی بادی های ضد فاکتور روماتوئید(RF) تا کنون محدود بوده است.RF یک مارکر سرولوژیک برای تشخیص RA با اختصاصیت 70 در صد می باشد.در چندین بررسی نشان داده شده که آنتی بادی هایی بر علیه بقایای سیترولین شده اسید آمینه آرژنین در پروتئین های الیاف غضروفی در بیماران RFمنفی مبتلا به آرتریت روماتوئید دیده می شود.اندازه گیری Anti-MCV بخصوص در بیماران RF منفی توصیه می شود.سیترولین شدن، یک واکنش آمیناز پپتدیل آرژنین بوده که اسید آمینه آرژنین را به سیترولین تبدیل می کند.سیترولین شدن اسیدهای آمینه اساسا در سلول ها انجام شده و در آن اسید آمینه آرژنین به یک ترکیب پروتئینی غیر معمول به نام سیترولین تبدیل می شود که سیستم ایمنی آن را غریبه به حساب آورده و بر علیه آن آنتی بادی می سازد؛آنتی بادی هایی که موجب التهاب و تخریب سلول های سینوویال در غضروف ها می گردند.انواع گوناگونی از پروتئین های سیترولین شده در بیماران RA پیدا شده اند.یکی از آنها Saآنتی ژن یا Mutated Citrullinated Vimentin یا (MCV) می باشد.
در تشخیص RA تعیین اتوآنتی بادی ها در مقابل MCV نقش تشخیصی و پیشگویی کننده دارد.انجام آن بسیار ارزشمندتر از آزمایش RF می باشد.انجام آزمایش Anti-MCV با روش الایزا دارای حساسیت و اختصاصیت بسیار بالا برای تشخیص اتوآنتی بادی های ضد Vimentin سیترولین شده می باشد.Vimentinیک پروتئین سیترولین شده حاضر در همه بخشها بخصوص بافت سینوویال بیماران مبتلا به آرتریت روماتوئید می باشد.تیتر آنتی بادی های ضد Vimentin در بیماران RA ارتباط قوی با درجه و شدت بیماری دارد.اخیرا یک تست سرولوژِک POCT برای تشخیص RF و Anti-MCV ابداع گردیده که دارای حساسیت 72 درصد و اختصاصیت 99.7 درصد می باشد.
Anti-MCV امروزه به عنوان یک بیومارکر کارآمد برای تشخیص پیشرفت RA مورد استفاده قرار می گیرد.ارزش اصلی این آزمایش در این است که ظهور اولیه این آنتی بادی ها تشخیص زودرس RA را فراهم آورده و موجبات درمان سریع و زودهنگام قبل از بروز علائم بیماری را فراهم می کند.بعلاوه میزان تیتر Anti-MCV ارتباط بسیار قوی با شدت و فعالیت بیماری و بالعکس موفقیت درمان دارد[/FONT]
منبع r.hamid ali assarian
r.hamid ali assarian
+ نوشته شده در سه شنبه بیست و دوم فروردین 1391ساعت توسط سیامک علی حیدری | 5 نظر
[h=2]لیزوزوم[/h][h=1]دید کلی [/h]هر یاخته یوکاریوتی دارای گروهی از اندامکهای سیتوپلاسمی به نام لیزوزومهاست که عمل اصلی آنها گوارش درون یاختهای و برون یاختهای است. لیزوزومها کیسههای محتوی آنزیمهای هیدرولاز اسیدی یک غشایی هستند. غشای لیزوزوم شبیه غشای پلاسمایی است ولی مقدار لیستین آن زیادتر و ضخیمتر از غشای میتوکندری است و قابلیت تلفیق با غشاهای دیگر از جمله وزیکولهای آندوسیتوزی را دارد که علت آن زیاد بودن لیپیدهای غشایی است.
لیزوزومها در سلولهای گیاهی ، جانوری و تک سلولیها وجود دارند. باکتریها لیزوزوم ندارند. لیزوزومها را در حکم کیسههای خودکشی و یا نارنجک درون سلولی مینامند که تخریب غشای آن میتواند موجب تجزیه مواد و اجزای درون سلول و در نتیجه لیزوزومها از غشا و ماده زمینه حاوی آنزیمهای مختلف تشکیل شده است.
ادامه مطلب
+ نوشته شده در دوشنبه بیست و ششم اردیبهشت 1390ساعت توسط سیامک علی حیدری | نظر بدهید
[h=2][/h]وقوع ليشمانيازيس به شاخصهايي از جمله ويرولانس گونه ليشمانيا، ژنتيك و پاسخ ايمني سلول ميزبان بستگي دارد. با گزش پشه خاكي آلوده و ورود انگل به بدن ميزبان، لازم است كه انگل وارد ماكروفاژ شده و در مقابل مكانيسم دفاعي ذاتي آنها دوام آورد. ورود انگل از طريق اتصال مولكولهاي موجود در سطح آن با گيرندههاي سطحي ماكروفاژ و سپس شروع عمل فاگوسيتوزيس رخ ميدهد. زمانيكه انگل وارد سلول شد، در واكوئل پارازيتوفوروس قرار گرفته و توسط غشاء سلول ميزبان احاطه ميشود.
ادامه مطلب
+ نوشته شده در شنبه شانزدهم بهمن 1389ساعت توسط سیامک علی حیدری | نظر بدهید
[h=2]آنتی بادیهای ضد پپتیدهای حلقوی سیترولینه (Anti cyclic citrullinated peptide) (Anti CCP) [/h]
[FONT=tahoma,arial,helvetica,sans-serif]آرتریت روماتوئید ([/FONT][FONT=tahoma,arial,helvetica,sans-serif]RA) شایعترین بیماری التهابی مفاصل به شمار میرود .که بطور متوسط حدود 1% جمعیت جوامع مختلف را مبتلا می کند .[/FONT] [FONT=tahoma,arial,helvetica,sans-serif]RA[/FONT][FONT=tahoma,arial,helvetica,sans-serif] یک بیماری اتوایمیون با مشخصه اصلی تخریب پیشرونده در مفاصل می باشد .دلایل متعددی وجود دارد که نشان می دهد با تشخیص زود رس و شروع به موقع درمانهای موثر امروزی ، می توان از تخریب مفاصل وناتوانی ناشی از آن جلوگیری کرد.[/FONT]
[FONT=tahoma,arial,helvetica,sans-serif]یکی از تستهای با ارزشی که در چند سال اخیر مطالعات زیاد ، اهمیت آنرا در تشخیص زودرس [/FONT][FONT=tahoma,arial,helvetica,sans-serif]RA نشان داده است ، آنتی بادیهای ضد پپتیدهای حلقوی سیترولینه (Anti cyclic citrullinated peptide) (Anti CCP[/FONT][FONT=tahoma,arial,helvetica,sans-serif]) می باشد. [/FONT]
[FONT=tahoma,arial,helvetica,sans-serif]سیستم آتوآنتی بادی ضد [/FONT][FONT=tahoma,arial,helvetica,sans-serif]CCP یک گروه از اتو آنتی بادیها هستند که واکنش گسترده بر علیه پروتئینهای حاوی آرژینین که به سیترولین تغییر یافته اند ، نشان میدهد . این اتوآنتی بادی ها شامل: آنتی پری نوکلئر فاکتور(APF) ، آنتی کراتین آنتی بادی(AKA) ، آنتی فیلاگرین آنتی بادی(AFA) و آنتیCCP از نوع IgG[/FONT][FONT=tahoma,arial,helvetica,sans-serif] می باشند.[/FONT]
[FONT=tahoma,arial,helvetica,sans-serif]نتایج تحقیقات مختلف بیانگر این نظریه است که سیترولینه شدن پروتئینها در داخل فضای ملتهب موضع که مبتلا به [/FONT][FONT=tahoma,arial,helvetica,sans-serif]RA[/FONT][FONT=tahoma,arial,helvetica,sans-serif] می باشد ممکن است در اثر آپوپتوزیس (مرگ برنامه ریزی شده وتریجی سلول) باشد.[/FONT]
[FONT=tahoma,arial,helvetica,sans-serif]انجام تست [/FONT][FONT=tahoma,arial,helvetica,sans-serif]Anti CCP به روش الایزا انجام می شود که در اینصورت 98% Specificity در سرم خون بیماران با RA قطعی (Definite or Established ) و 96% اختصاصیت در سرم خون بیماران با RA Early[/FONT][FONT=tahoma,arial,helvetica,sans-serif] (کمتر از یکسال از شروع علایم بیماری) نشان می دهد.[/FONT]
[FONT=tahoma,arial,helvetica,sans-serif]البته [/FONT][FONT=tahoma,arial,helvetica,sans-serif]RF که تست سرولوژیک استاندارد برای تشخیصRA به شمار میرود فقط 95-90% Specificity دارد (تنها در روش ELISA ، نه روشهای ضعیف تر دیگر مثل آگلوتیناسیون، نفلومتری و...). اما RF نوع IgM نه اختصاصی ونه جهت تشخیص RA[/FONT][FONT=tahoma,arial,helvetica,sans-serif] کاملا حساس می باشد.[/FONT]
در تشخیص RA تعیین اتوآنتی بادی ها در مقابل MCV نقش تشخیصی و پیشگویی کننده دارد.انجام آن بسیار ارزشمندتر از آزمایش RF می باشد.انجام آزمایش Anti-MCV با روش الایزا دارای حساسیت و اختصاصیت بسیار بالا برای تشخیص اتوآنتی بادی های ضد Vimentin سیترولین شده می باشد.Vimentinیک پروتئین سیترولین شده حاضر در همه بخشها بخصوص بافت سینوویال بیماران مبتلا به آرتریت روماتوئید می باشد.تیتر آنتی بادی های ضد Vimentin در بیماران RA ارتباط قوی با درجه و شدت بیماری دارد.اخیرا یک تست سرولوژِک POCT برای تشخیص RF و Anti-MCV ابداع گردیده که دارای حساسیت 72 درصد و اختصاصیت 99.7 درصد می باشد.
Anti-MCV امروزه به عنوان یک بیومارکر کارآمد برای تشخیص پیشرفت RA مورد استفاده قرار می گیرد.ارزش اصلی این آزمایش در این است که ظهور اولیه این آنتی بادی ها تشخیص زودرس RA را فراهم آورده و موجبات درمان سریع و زودهنگام قبل از بروز علائم بیماری را فراهم می کند.بعلاوه میزان تیتر Anti-MCV ارتباط بسیار قوی با شدت و فعالیت بیماری و بالعکس موفقیت درمان دارد[/FONT]
منبع
 r.hamid ali assarian
r.hamid ali assarian+ نوشته شده در سه شنبه بیست و دوم فروردین 1391ساعت توسط سیامک علی حیدری | 5 نظر
[h=2]لیزوزوم[/h][h=1]دید کلی [/h]هر یاخته یوکاریوتی دارای گروهی از اندامکهای سیتوپلاسمی به نام لیزوزومهاست که عمل اصلی آنها گوارش درون یاختهای و برون یاختهای است. لیزوزومها کیسههای محتوی آنزیمهای هیدرولاز اسیدی یک غشایی هستند. غشای لیزوزوم شبیه غشای پلاسمایی است ولی مقدار لیستین آن زیادتر و ضخیمتر از غشای میتوکندری است و قابلیت تلفیق با غشاهای دیگر از جمله وزیکولهای آندوسیتوزی را دارد که علت آن زیاد بودن لیپیدهای غشایی است.
لیزوزومها در سلولهای گیاهی ، جانوری و تک سلولیها وجود دارند. باکتریها لیزوزوم ندارند. لیزوزومها را در حکم کیسههای خودکشی و یا نارنجک درون سلولی مینامند که تخریب غشای آن میتواند موجب تجزیه مواد و اجزای درون سلول و در نتیجه لیزوزومها از غشا و ماده زمینه حاوی آنزیمهای مختلف تشکیل شده است.
ادامه مطلب
+ نوشته شده در دوشنبه بیست و ششم اردیبهشت 1390ساعت توسط سیامک علی حیدری | نظر بدهید
[h=2][/h]وقوع ليشمانيازيس به شاخصهايي از جمله ويرولانس گونه ليشمانيا، ژنتيك و پاسخ ايمني سلول ميزبان بستگي دارد. با گزش پشه خاكي آلوده و ورود انگل به بدن ميزبان، لازم است كه انگل وارد ماكروفاژ شده و در مقابل مكانيسم دفاعي ذاتي آنها دوام آورد. ورود انگل از طريق اتصال مولكولهاي موجود در سطح آن با گيرندههاي سطحي ماكروفاژ و سپس شروع عمل فاگوسيتوزيس رخ ميدهد. زمانيكه انگل وارد سلول شد، در واكوئل پارازيتوفوروس قرار گرفته و توسط غشاء سلول ميزبان احاطه ميشود.
ادامه مطلب
+ نوشته شده در شنبه شانزدهم بهمن 1389ساعت توسط سیامک علی حیدری | نظر بدهید
[h=2]آنتی بادیهای ضد پپتیدهای حلقوی سیترولینه (Anti cyclic citrullinated peptide) (Anti CCP) [/h]
[FONT=tahoma,arial,helvetica,sans-serif]آرتریت روماتوئید ([/FONT][FONT=tahoma,arial,helvetica,sans-serif]RA) شایعترین بیماری التهابی مفاصل به شمار میرود .که بطور متوسط حدود 1% جمعیت جوامع مختلف را مبتلا می کند .[/FONT] [FONT=tahoma,arial,helvetica,sans-serif]RA[/FONT][FONT=tahoma,arial,helvetica,sans-serif] یک بیماری اتوایمیون با مشخصه اصلی تخریب پیشرونده در مفاصل می باشد .دلایل متعددی وجود دارد که نشان می دهد با تشخیص زود رس و شروع به موقع درمانهای موثر امروزی ، می توان از تخریب مفاصل وناتوانی ناشی از آن جلوگیری کرد.[/FONT]
[FONT=tahoma,arial,helvetica,sans-serif]یکی از تستهای با ارزشی که در چند سال اخیر مطالعات زیاد ، اهمیت آنرا در تشخیص زودرس [/FONT][FONT=tahoma,arial,helvetica,sans-serif]RA نشان داده است ، آنتی بادیهای ضد پپتیدهای حلقوی سیترولینه (Anti cyclic citrullinated peptide) (Anti CCP[/FONT][FONT=tahoma,arial,helvetica,sans-serif]) می باشد. [/FONT]
[FONT=tahoma,arial,helvetica,sans-serif]سیستم آتوآنتی بادی ضد [/FONT][FONT=tahoma,arial,helvetica,sans-serif]CCP یک گروه از اتو آنتی بادیها هستند که واکنش گسترده بر علیه پروتئینهای حاوی آرژینین که به سیترولین تغییر یافته اند ، نشان میدهد . این اتوآنتی بادی ها شامل: آنتی پری نوکلئر فاکتور(APF) ، آنتی کراتین آنتی بادی(AKA) ، آنتی فیلاگرین آنتی بادی(AFA) و آنتیCCP از نوع IgG[/FONT][FONT=tahoma,arial,helvetica,sans-serif] می باشند.[/FONT]
[FONT=tahoma,arial,helvetica,sans-serif]نتایج تحقیقات مختلف بیانگر این نظریه است که سیترولینه شدن پروتئینها در داخل فضای ملتهب موضع که مبتلا به [/FONT][FONT=tahoma,arial,helvetica,sans-serif]RA[/FONT][FONT=tahoma,arial,helvetica,sans-serif] می باشد ممکن است در اثر آپوپتوزیس (مرگ برنامه ریزی شده وتریجی سلول) باشد.[/FONT]
[FONT=tahoma,arial,helvetica,sans-serif]انجام تست [/FONT][FONT=tahoma,arial,helvetica,sans-serif]Anti CCP به روش الایزا انجام می شود که در اینصورت 98% Specificity در سرم خون بیماران با RA قطعی (Definite or Established ) و 96% اختصاصیت در سرم خون بیماران با RA Early[/FONT][FONT=tahoma,arial,helvetica,sans-serif] (کمتر از یکسال از شروع علایم بیماری) نشان می دهد.[/FONT]
[FONT=tahoma,arial,helvetica,sans-serif]البته [/FONT][FONT=tahoma,arial,helvetica,sans-serif]RF که تست سرولوژیک استاندارد برای تشخیصRA به شمار میرود فقط 95-90% Specificity دارد (تنها در روش ELISA ، نه روشهای ضعیف تر دیگر مثل آگلوتیناسیون، نفلومتری و...). اما RF نوع IgM نه اختصاصی ونه جهت تشخیص RA[/FONT][FONT=tahoma,arial,helvetica,sans-serif] کاملا حساس می باشد.[/FONT]
[FONT=tahoma,arial,helvetica,sans-serif]بنابراین تعیین آنتی بادی های [/FONT][FONT=tahoma,arial,helvetica,sans-serif]Anti-CCP امکان تشخیص بهتر Early RA را از سایر پلی آرتریتهای التهابی(non-RA[/FONT][FONT=tahoma,arial,helvetica,sans-serif]) فراهم می کند.[/FONT]
[FONT=tahoma,arial,helvetica,sans-serif]اگرچه حساسیت تست آنتی بادی [/FONT][FONT=tahoma,arial,helvetica,sans-serif]CCP کمتر از RF(68% در مقابل 80%( می باشد، اما آنتی بادیهای ضدCCP در سرم خون بیماران RA که RF[/FONT][FONT=tahoma,arial,helvetica,sans-serif] منفی باشند ، یافت می شود .[/FONT]
[FONT=tahoma,arial,helvetica,sans-serif]در کاربرد های کلینیکی ترکیب آزمایش [/FONT][FONT=tahoma,arial,helvetica,sans-serif]Anti-CCP وRF حساسیت سرولوژیک تشخیص RA را بهبود می بخشد.[/FONT] [FONT=tahoma,arial,helvetica,sans-serif]IU/mL 15 Anti-CCP[/FONT][FONT=tahoma,arial,helvetica,sans-serif]> در سرم ، مثبت تلقی می شود.[/FONT]
[FONT=tahoma,arial,helvetica,sans-serif]سیستم اتوآنتی بادی های ضد [/FONT][FONT=tahoma,arial,helvetica,sans-serif]CCP ، RA نوع مخرب (Erosive ) وسیربیماری خیلی شدید ارتباط فراوان دارد. بنابراین سیستم یاد شده می تواند در تصمیم گیری کلینیکی برای درمان RA[/FONT][FONT=tahoma,arial,helvetica,sans-serif] ،تعیین کننده باشد .[/FONT]
[FONT=tahoma,arial,helvetica,sans-serif]نکته ظریف تر اینکه [/FONT][FONT=tahoma,arial,helvetica,sans-serif]Anti-CCP در تعیین افراد مبتلا به RA حتی سالها قبل از شروع علایم و سینوویت مخرب می توان بکار برد (البته در حدود یک سوم موارد بصورت Predictor[/FONT][FONT=tahoma,arial,helvetica,sans-serif] هستند).[/FONT]
[FONT=tahoma,arial,helvetica,sans-serif]اگرچه حساسیت تست آنتی بادی [/FONT][FONT=tahoma,arial,helvetica,sans-serif]CCP کمتر از RF(68% در مقابل 80%( می باشد، اما آنتی بادیهای ضدCCP در سرم خون بیماران RA که RF[/FONT][FONT=tahoma,arial,helvetica,sans-serif] منفی باشند ، یافت می شود .[/FONT]
[FONT=tahoma,arial,helvetica,sans-serif]در کاربرد های کلینیکی ترکیب آزمایش [/FONT][FONT=tahoma,arial,helvetica,sans-serif]Anti-CCP وRF حساسیت سرولوژیک تشخیص RA را بهبود می بخشد.[/FONT] [FONT=tahoma,arial,helvetica,sans-serif]IU/mL 15 Anti-CCP[/FONT][FONT=tahoma,arial,helvetica,sans-serif]> در سرم ، مثبت تلقی می شود.[/FONT]
[FONT=tahoma,arial,helvetica,sans-serif]سیستم اتوآنتی بادی های ضد [/FONT][FONT=tahoma,arial,helvetica,sans-serif]CCP ، RA نوع مخرب (Erosive ) وسیربیماری خیلی شدید ارتباط فراوان دارد. بنابراین سیستم یاد شده می تواند در تصمیم گیری کلینیکی برای درمان RA[/FONT][FONT=tahoma,arial,helvetica,sans-serif] ،تعیین کننده باشد .[/FONT]
[FONT=tahoma,arial,helvetica,sans-serif]نکته ظریف تر اینکه [/FONT][FONT=tahoma,arial,helvetica,sans-serif]Anti-CCP در تعیین افراد مبتلا به RA حتی سالها قبل از شروع علایم و سینوویت مخرب می توان بکار برد (البته در حدود یک سوم موارد بصورت Predictor[/FONT][FONT=tahoma,arial,helvetica,sans-serif] هستند).[/FONT]
[FONT=tahoma,arial,helvetica,sans-serif]مسلماً این پیشگویی ابتلا به [/FONT][FONT=tahoma,arial,helvetica,sans-serif]RA، همراه در ترکیب با ارزیابی جهت سایر ریسک فاکتورهای پیدایش RA یعنی زمینه مساعد ژنتیک ، سابقه فامیلی مثبت و وجود سایر اتوآنتی بادیها موثرتر خواهد بود. نکته آخر اینکه تحقیقات اخیر نشان می دهد اگر طول مدت بیماری RA کوتاهتر باشد، با درمان سطح آنتی CCP بیشتر کاهش می یابد[/FONT]
[FONT=tahoma,arial,helvetica,sans-serif][/FONT]
[FONT=tahoma,arial,helvetica,sans-serif]منبع :www.med-labjour.com[/FONT]
[FONT=tahoma,arial,helvetica,sans-serif][/FONT]
[FONT=tahoma,arial,helvetica,sans-serif]منبع :www.med-labjour.com[/FONT]
| دستگاه لنفاوی یک راه فرعی برای جریان مایع از فضاهای میان بافتی به سوی خون میباشد. مهمترین نکته این است که دستگاه لنفاوی میتواند پروتئینها و ذرات بزرگ را از فضاهای بافتی دور کند، در حالی که هیچ یک از آنها نمیتوانند مستقیما جذب خون مویرگی شوند. ضرورت این عمل برداشت پروتئینها از فضاهای میان بافتی به گونهای است که بدون آن ظرف 24 ساعت خواهیم مرد. |
|
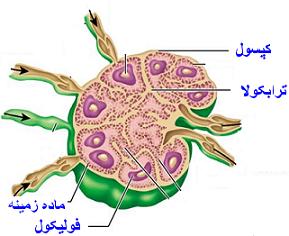
| برش عرضی عقده لنفاوی |
[h=1]بافتهای لنفاوی [/h]عمدهترین سلولهای تشکیل دهنده بافتهای لنفاوی ، لنفوسیتها هستند که به همراه آنها سلولهای دیگری نظیر پلاسماسلها و ماکروفاژها نیز دیده میشوند. سلولهای تشکیل دهنده بافتهای لنفاوی بر روی داربستی از سلولها و الیاف رتیکولر قرار دارند و معمولا به دو صورت ندولر و منتشر دیده میشوند. ندولها یا همان گرهک به دو صورت اولیه و ثانویه وجود دارد. ندولهای اولیه ندولهایی هستند که در آنها تراکم سلولها یکنواخت میباشد و عمدتا از لنفوسیتهای کوچک تشکیل شدهاند. ندولهای ثانویه ندولهایی هستند که دارای یک ناحیه متراکم و تیره محیطی و یک ناحیه کم تراکم روشن مرکزی به نام مرکز زایا میباشد.
[h=1]اعضای لنفاوی [/h]اعضای لنفاوی در مقایسه با بافتهای لنفاوی توسط کپسولی از بافت همبند احاطه شدهاند و به عنوان ارگانی مستقل محسوب میشوند. اعضای لنفاوی به دو دسته تقسیم میگردند. اعضای لنفاوی اولیه شامل مغز استخوان و تیموس میباشد که محل تمایز لنفوسیتها هستند و اعضای لنفاوی ثانویه شامل عقدهای لنفی ، طحال ، لوزهها و پلاکهای پییر میباشد که محل استقرار لنفوسیتهای تمایز یافته میباشد.
[h=2]اعضای لنفاوی اولیه [/h]
[h=2]اعضای لنفاوی اولیه [/h]
- مغز استخوان: که بافت نرم و پر عروقی است که حفره مرکزی استخوانهای دراز و فضاهای بین ترابکولی استخوانهای اسفنجی را پر میکند.
- تیموس: تیموس ارگانی است که در زیر قسمت فوقانی جناغ سینه رشد و تکامل مییابد. وزن تیموس در مقایسه با وزن کل بدن در زمان تولد حداکثر میباشد و به عنوان عضو لنفاوی اولیه محل تولید لنفوسیت T می باشد. وظیفه اصلی تیموس این است که محلی برای تکثیر و تمایز لنفوسیتهای T میباشد که این امر تحت تاثیر فاکتورهای مترشحه از تیموس انجام میگیرد. تیموس پس از بلوغ سیر قهقرایی آغاز میکند که طی آن جمعیت لنفوسیتها کاهش یافته و بوسیله بافت چربی جایگزین میشود.
[h=2]اعضای لنفاوی ثانویه [/h]
- عقدهای لنفی:
عقدهای لنفی ساختمانهایی هستند لوبیایی شکل پوشیده شده بوسیله کپسولی همبندی که در سراسر بدن در مسیر رگهای لنفی قرار گرفتهاند، عقدهای لنفی در زیر بغل ، کشاله ران ، در امتداد رگهای بزرگ گردن ، قفسه سینه و مزانتر به تعداد زیاد و به صورت گروهی یافت میشوند. هر عقده دارای یک قسمت محدب و یک ناحیه فرو رفته به نام ناف میباشد که ناف عقده محل ورود شریان و اعصاب و خروج رگهای لنفی وابران و وریدی میباشد. لنف توسط رگهای لنفی آوران و از سطح محدب وارد عقده شده و پس از فیلتره شدن در عقده توسط رگهای لنفی وابران از ناحیه ناف عقده خارج میگردد. از نظر ساختمان بافتی هر عقده دارای یک ناحیه قشری و یک ناحیه مغزی است.
- طحال:
طحال به وزن تقریبی 200 گرم بزرگترین ارگان لنفی بدن است که در حفره شکمی زیر دیافراگم و پشت معده قرار دارد. طحال در مسیر گردش خون قرار دارد و نسبت به آنتیژنهایی که وارد خون میشوند حساسیت نشان میدهد و بنابراین محل تصفیه خون است. علاوه بر فعالیتهای ایمنی ، طحال محل برداشت گویچههای قرمزپیر و پلاکتها میباشد. در طحال نواحی سفید رنگی به نام پالپ سفید دیده میشوند که در زمینه قرمز و پر خونی به نام پالپ قرمز قرار گرفتهاند. با توجه به اعمال طحال برداشت طحال با پیدایش گلبولهای قرمز غیره طبیعی ، افزایش پلاکها و افزایش احتمال بروز عفونتهای خونی همراه میباشد ولی مشکل جدی ایجاد نمیکند.
لوزهها:
لوزهها مجموعهای از ندولهای هستند که در ابتدای لوله گوارش قرار گرفتهاند. لنفوسیتهای تولید شده در لوزهها به داخل اپیتلیوم پوشاننده آنها نفوذ کرده و نهایتا دفع میشوند. لوزهها بر اساس موقعیت خود تحت عنوان کامی ، زبانی و حلقی نامگذاری شدهاند:
پلاکهای پییر: در دیواره روده باریک بخصوص ایلئوم ، چندین ندول لنفاوی مجتمع شده و تودههای وسیعی را بوجود میآورند که پلاک پییر (peyers patch) نامیده میشوند.
لوزهها مجموعهای از ندولهای هستند که در ابتدای لوله گوارش قرار گرفتهاند. لنفوسیتهای تولید شده در لوزهها به داخل اپیتلیوم پوشاننده آنها نفوذ کرده و نهایتا دفع میشوند. لوزهها بر اساس موقعیت خود تحت عنوان کامی ، زبانی و حلقی نامگذاری شدهاند:
پلاکهای پییر: در دیواره روده باریک بخصوص ایلئوم ، چندین ندول لنفاوی مجتمع شده و تودههای وسیعی را بوجود میآورند که پلاک پییر (peyers patch) نامیده میشوند.
[h=1]تشکیل لنف [/h]مایع میان بافتی که وارد عروق لنفاوی میشود لنف را میسازد لذا ترکیب لنف اولیهای که در بافت جریان مییابد تقریبا با مایع میان بافتی یکسان است. غلظت پروتئین در مایع میان بافتی اکثر بافتها بطور متوسط حدود 2g/dl است و غلظت پروتئین لنف جاری در این بافتها نیز نزدیک مقدار مزبور است غلظت پروتئین در لنفی که در کبد تشکیل میشود تا حد 6g/dl میرسد و غلظت پروتئین لنفی که در رودهها تشکیل میشود تا 43g/dl میرسد.
حدود 3/2 کل لنف بدن در حالت طبیعی از کبد و رودهها بوجود میآید لذا غلظت پروتئین در لنف مجرای توراسیک (کانالی که لنف تمام قسمتهای تحتانی از آن به بالا جریان مییابد) که مخلوطی از لنف تمام بدن است معمولا 53g/dl میباشد.(dl همان دسی لیتر است) صمنا دستگاه لنفی یکی از راههای اصلی جذب مواد غذایی از دستگاه گوارشی است، زیرا مسئولیت اصلی جذب چربیها را بر عهده دارد. بالاخره اینکه حتی ذرات بزرگ نظیر باکتریها نیز میتوانند از طریق سلولهای اندوتلیال مویرگهای لنفاوی به لنف راه یابد. هنگامی که لنف از غدد لنفاوی میگذرد، این ذرات برداشته و تخریب میشود.
[h=1]عوامل موثر بر جریان لنف [/h][h=2]تاثیر فشار مایع میان بافتی بر جریان لنف [/h]تاثیر فشار مایع میان بافتی بر جریان لنف اگر عملکرد عروق لنفاوی طبیعی باشد، هر عاملی که فشار مایع میان بافتی را افزایش دهد، در حالت طبیعی جریان لنف را نیز زیاد میکند. برخی از این عوامل عبارتند از افزایش فشار مویرگی ، کاهش فشار اسمزی کلوئیدی پلاسما ، افزایش پروتئین مایع میان بافتی و افزایش نفوذپذیری مویرگها. کلیه این عوامل باعث میشوند تعادل تبادل مایع در محل غشای مویرگ خونی به گونهای تغییر کند که مایع بیشتری وارد فضای میان بافتی شود، و در نتیجه بطور همزمان حجم مایع میان بافتی ، فشار مایع میان بافتی و جریان لنف نیز افزایش یابد.
البته اگر فشار مایع میان بافتی 1تا 2 میلیمتر جیوه از فشار جو بیشتر باشد، دیگر باعث افزایش جریان لنف نمیشود، زیرا افزایش فشار بافت علاوه بر افزون بر مایعی که وارد مویرگهای لنفاوی میشود، سطح خارجی عروق لنفاوی بزرگتر را نیز میفشارد و مانع از جریان لنف میشود. این دو عامل در فشارهای بالا تقریبا بطور کامل همدیگر را خنثی میکنند، به نحوی که جریان لنف به حداکثر میزان خود میرسد.
حدود 3/2 کل لنف بدن در حالت طبیعی از کبد و رودهها بوجود میآید لذا غلظت پروتئین در لنف مجرای توراسیک (کانالی که لنف تمام قسمتهای تحتانی از آن به بالا جریان مییابد) که مخلوطی از لنف تمام بدن است معمولا 53g/dl میباشد.(dl همان دسی لیتر است) صمنا دستگاه لنفی یکی از راههای اصلی جذب مواد غذایی از دستگاه گوارشی است، زیرا مسئولیت اصلی جذب چربیها را بر عهده دارد. بالاخره اینکه حتی ذرات بزرگ نظیر باکتریها نیز میتوانند از طریق سلولهای اندوتلیال مویرگهای لنفاوی به لنف راه یابد. هنگامی که لنف از غدد لنفاوی میگذرد، این ذرات برداشته و تخریب میشود.
[h=1]عوامل موثر بر جریان لنف [/h][h=2]تاثیر فشار مایع میان بافتی بر جریان لنف [/h]تاثیر فشار مایع میان بافتی بر جریان لنف اگر عملکرد عروق لنفاوی طبیعی باشد، هر عاملی که فشار مایع میان بافتی را افزایش دهد، در حالت طبیعی جریان لنف را نیز زیاد میکند. برخی از این عوامل عبارتند از افزایش فشار مویرگی ، کاهش فشار اسمزی کلوئیدی پلاسما ، افزایش پروتئین مایع میان بافتی و افزایش نفوذپذیری مویرگها. کلیه این عوامل باعث میشوند تعادل تبادل مایع در محل غشای مویرگ خونی به گونهای تغییر کند که مایع بیشتری وارد فضای میان بافتی شود، و در نتیجه بطور همزمان حجم مایع میان بافتی ، فشار مایع میان بافتی و جریان لنف نیز افزایش یابد.
البته اگر فشار مایع میان بافتی 1تا 2 میلیمتر جیوه از فشار جو بیشتر باشد، دیگر باعث افزایش جریان لنف نمیشود، زیرا افزایش فشار بافت علاوه بر افزون بر مایعی که وارد مویرگهای لنفاوی میشود، سطح خارجی عروق لنفاوی بزرگتر را نیز میفشارد و مانع از جریان لنف میشود. این دو عامل در فشارهای بالا تقریبا بطور کامل همدیگر را خنثی میکنند، به نحوی که جریان لنف به حداکثر میزان خود میرسد.
[h=2]پمپ لنفاوی جریان لنف را افزایش میدهد [/h]تصاویر متحرک بدست آمده از عروق لنفاوی انسان و حیوان نشان میدهد که هر گاه مایع باعث کشیدگی لنفاتیک جمع کننده یا عروق لنفی بزرگتر شود، عضله جدار رگ بطور خودکار منقبض میشود. ضمنا هر یک از قطعات رگ که بین دو دریچه متوالی قرار دارد، به عنوان یک پمپ خودکار مجزا عمل میکند. به عبارت دیگر پر شدن هر قطعه باعث انقباض آن میشود و مایع از طریق دریچه بعدی وارد قطعه بعدی میشود. این روند در سراسر طول رگ لنفی ادامه مییابد تا نهایتا مایع لنف تخلیه شود.
[h=2]پمپ ناشی از فشار متناوب خارجی بر لنفاتیک [/h]هر گونه عامل خارجی که رگ لنفی را به تناوب بفشارد، میتواند آن را وارد به پمپ نماید. این عوامل به ترتیب اهمیت عبارتند از انقباض عضلات اطراف ، حرکت فسمتهایی از بدن ، ضربانات شریانی و فشار اجسام خارج از بدن بر بافت پمپ لنفاوی هنگام فعالیت فرد بسیار فعال است و جریان لنف را غالبا 10 تا 30 برابر میکند. از طرف دیگر لنف در حین استراحت بسیار کند (در حد صفر) است.
[h=2]پمپ ناشی از فشار متناوب خارجی بر لنفاتیک [/h]هر گونه عامل خارجی که رگ لنفی را به تناوب بفشارد، میتواند آن را وارد به پمپ نماید. این عوامل به ترتیب اهمیت عبارتند از انقباض عضلات اطراف ، حرکت فسمتهایی از بدن ، ضربانات شریانی و فشار اجسام خارج از بدن بر بافت پمپ لنفاوی هنگام فعالیت فرد بسیار فعال است و جریان لنف را غالبا 10 تا 30 برابر میکند. از طرف دیگر لنف در حین استراحت بسیار کند (در حد صفر) است.
[h=2]پمپ مویرگهای لنفاوی [/h]علاوه بر عمل پمپی انقباض لنفاوی عضلانی بزرگتر ، ممکن است حداقل بخشی از پمپ لنفاوی ناشی از انقباض سلولهای اندوتلیال مویرگهای لنفی باشد.
[h=1]نقش دستگاه لنفاوی در کنترل غلظت پروتئین ، حجم و فشار مایع میان بافتی [/h]دستگاه لنفاوی در کنترل موارد زیر نقش محوری دارد. اول غلظت پروتئینهای مایعات بینابینی ، دوم مایع میان بافتی و سوم فشار مایع میان بافتی. همواره مقدار کمی از مویرگهای خونی به فضای میان بافتی نشست میکند. مقدار پروتئینی که از طریق سر وریدی مویرگهای خونی به گردش خون باز میگردد ناچیز یا صفر است. لذا این پروتئینها معمولا در مایع میان بافتی جمع میشوند و فشار اسمزی کلوئیدی آن افزایش میدهد.
افزایش فشار اسمزی کلوئیدی مایع میان بافتی باعث فیلتراسیون بیشتر مایع به درون فضای میان بافتی میشود و لذا حجم و فشار مایع میان بافتی افزایش مییابد. افزایش فشار مایع میان بافتی تا حدود زیادی جریان لنف را تسریع میکند و بدین ترتیب مایع میان بافتی و پروتئینهای اضافی که در فضاها جمع شده بود از بافتها دور میشود. بازگشت پروتئین و مایع از طریق دستگاه لنفاوی تا حدی زیاد میشود که میتواند با میزان نشست پروتئین و مایع از مویرگهای خونی به تعادل کامل برسد.
+ نوشته شده در پنجشنبه هجدهم مهر 1387ساعت توسط سیامک علی حیدری | آرشیو نظرات
[h=2][/h]
[h=1]نقش دستگاه لنفاوی در کنترل غلظت پروتئین ، حجم و فشار مایع میان بافتی [/h]دستگاه لنفاوی در کنترل موارد زیر نقش محوری دارد. اول غلظت پروتئینهای مایعات بینابینی ، دوم مایع میان بافتی و سوم فشار مایع میان بافتی. همواره مقدار کمی از مویرگهای خونی به فضای میان بافتی نشست میکند. مقدار پروتئینی که از طریق سر وریدی مویرگهای خونی به گردش خون باز میگردد ناچیز یا صفر است. لذا این پروتئینها معمولا در مایع میان بافتی جمع میشوند و فشار اسمزی کلوئیدی آن افزایش میدهد.
افزایش فشار اسمزی کلوئیدی مایع میان بافتی باعث فیلتراسیون بیشتر مایع به درون فضای میان بافتی میشود و لذا حجم و فشار مایع میان بافتی افزایش مییابد. افزایش فشار مایع میان بافتی تا حدود زیادی جریان لنف را تسریع میکند و بدین ترتیب مایع میان بافتی و پروتئینهای اضافی که در فضاها جمع شده بود از بافتها دور میشود. بازگشت پروتئین و مایع از طریق دستگاه لنفاوی تا حدی زیاد میشود که میتواند با میزان نشست پروتئین و مایع از مویرگهای خونی به تعادل کامل برسد.
+ نوشته شده در پنجشنبه هجدهم مهر 1387ساعت توسط سیامک علی حیدری | آرشیو نظرات
[h=2][/h]
| آنتیژن مادهای است که توانایی تحریک دستگاه ایمنی بدن جانور را دارد و اختصاصا با آنتیکورهای تولید شده توسط دستگاه ایمنی واکنش میدهد. ماهیت شیمیایی آنتی ژن میتواند پروتئین ، پلی ساکارید ، لیپید و حتی اسید نوکلئیک باشد. |
[h=1]مقدمه [/h]سالها قبل از کشف میکرو ارگانیسمها معلوم شده بود که یکبار ابتلا به بیماری نظیر آبله فرد بهبود یافته را اختصاصا در برابر آن بیماری ایمن میسازد. در قرن 19 لوئی پاستور رابرت کوخ کوششی جهت بررسی امکان ایمن سازی انسان با میکروبهای سیاه زخم ، هاری و سایر بیماریها به عمل آوردند. آنها دریافتند که ایجاد ایمنی در صورتی امکان دارد که این قبیل میکروبها طوری تغییر داده شوند که قدرت بیماریزایی خود را از دست داده یا کشته شوند. در این پژوهشها مولکولهایی که در چنین واکنشهایی تمایل به یکدیگر دارند مشخص میشود. ایمنی طبیعی موروثی بوده و مستقل از برخورد قبلی با آنتی ژنها است.
ایمنی اکتسابی به تولید یا کسب آنتی کور یا سلولهای ایمنی اختصاص یافته بستگی داشته و از اینرو اختصاصی میباشد. آنتی کور پروتئینی است که بدن در پاسخ به وجود یک آنتی ژن تولید کرده و این ماده اختصاصا میتواند با همان آنتیکور ترکیب شود. ویژگی یک مولکول آنتی ژن یا آنتی کور با اندازه و شکل شاخص آنتی ژن و محل واکنشگر آنتی کور مربوطه تعیین میگردد. زیرا بایستی بین آن دو تناسب فیزیکی تکمیلی دقیقی وجود داشته باشد. هر ماده بیگانهای قادر به ایجاد پاسخ ایمنی نیست.
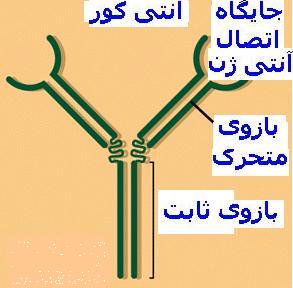
|
ایمنی اکتسابی به تولید یا کسب آنتی کور یا سلولهای ایمنی اختصاص یافته بستگی داشته و از اینرو اختصاصی میباشد. آنتی کور پروتئینی است که بدن در پاسخ به وجود یک آنتی ژن تولید کرده و این ماده اختصاصا میتواند با همان آنتیکور ترکیب شود. ویژگی یک مولکول آنتی ژن یا آنتی کور با اندازه و شکل شاخص آنتی ژن و محل واکنشگر آنتی کور مربوطه تعیین میگردد. زیرا بایستی بین آن دو تناسب فیزیکی تکمیلی دقیقی وجود داشته باشد. هر ماده بیگانهای قادر به ایجاد پاسخ ایمنی نیست.
[h=1]ساختمان آنتی ژن [/h]اغلب آنتی ژنها مولکولهای درشتی هستند. از لحاظ ترکیب شیمیایی آنتی ژنها ممکن است پروتئین ، پلی ساکارید ، چربیها و حتی اسید نوکلئیک هم باشند. یکی دیگر از صفات اختصاصی آنتی ژنها بیگانه بودن آنها نسبت به بدن میزبان است.در غیر این صورت یک فرد میتوانست از نظر ایمنی نسبت به مواد بدن خود واکنش نشان داده و در نتیجه آسیبهای بافتی پدید آید. در شرایط غیر طبیعی این چنین پیش آمدی رخ میدهد و بیماریهایی به نام بیماریهای خود ایمنی ایجاد میشود. گرچه موادی که وزن مولکولی کوچک دارند خود غالبا آنتی ژنیک نیستند ولی میتوانند به عنوان هاپتن عمل کنند.
هاپتن مادهای است که قادر است با آنتیکور واکنش نشان دهد ولی نمیتواند محرک تولید آنتیکور واقع شود. بنابراین یک هاپتن ممکن است یک شاخص آنتی ژنی یا بخشی از آن باشد.به عنوان مثال پنیسیلین مادهای با وزن مولکولی کم است که به تنهایی خاصیت آنتی ژنی ندارد ولی در بدن مواد حاصل از تجزیه آن به صورت هاپتن عمل کرده و میتواند با پروتئینهای درشت مولکول بدن ترکیب یافته و کمپکسهای ناقل هاپتن با خاصیت آنتی ژنی ایجاد نماید. توانایی بسیاری از مولکولهای کوچک در ایجاد خاصیت هاپتن احتمال واکنشهای ایمنی را که علیه مواد بیگانه ایجاد میگردد فوقالعاده افزایش میدهد.
|
هاپتن مادهای است که قادر است با آنتیکور واکنش نشان دهد ولی نمیتواند محرک تولید آنتیکور واقع شود. بنابراین یک هاپتن ممکن است یک شاخص آنتی ژنی یا بخشی از آن باشد.به عنوان مثال پنیسیلین مادهای با وزن مولکولی کم است که به تنهایی خاصیت آنتی ژنی ندارد ولی در بدن مواد حاصل از تجزیه آن به صورت هاپتن عمل کرده و میتواند با پروتئینهای درشت مولکول بدن ترکیب یافته و کمپکسهای ناقل هاپتن با خاصیت آنتی ژنی ایجاد نماید. توانایی بسیاری از مولکولهای کوچک در ایجاد خاصیت هاپتن احتمال واکنشهای ایمنی را که علیه مواد بیگانه ایجاد میگردد فوقالعاده افزایش میدهد.
[h=1]تحمل پذیری ایمنی [/h]فاکتورهای متعددی از جمله سازمان ژنتیکی در تعیین واکنش میزبان نسبت به آنتی ژن خاص دخالت دارد. عدم توانایی ایجاد پاسخ ایمنی نسبت به آنتی ژن قوی را تحمل پذیری ایمنی نامند. تشخیص بافت خودی و در نتیجه عدم واکنش ایمنی نسبت به ماده خودی شکلی از تحمل پذیری است. مکانیسمهای کنترل پیچیدهای در این پدیده عمل میکنند که در حال حاضر فقط تعداد معدودی از آنها شناخته شده است.
[h=1]مکانیسم عمل آنتی ژنها [/h]هنگامی که آنتی ژن بیگانه وارد بدن میشود به سرعت از راه بافت لنفاوی در خون نفوذ کرده و سرانجام بوسیله ماکروفاژها از گردش خون خارج میگردد. در درون ماکروفاژها انواع مولکولهای درشت و ذرات بلعیده شده به کمک آنزیمها به مولکولهای آنتی ژنیک کوچک تبدیل میشوند. این مولکولها خود را به سلولهای سازنده آنتیکور میرسانند ماکروفاژها خود قدرت تولید آنتیکور را ندارند ولی غالبا در پاسخهای آنتی کوری نقشی به عهده دارند زیرا آنها آنتی ژنها را آماده کرده و آنگاه آنها رابه لنفوسیتهای واکنشگر معرفی میکنند. آنتی کورهای تولید شده وارد جریان خون شده و واکنشهای دستگاه ایمنی را بکار میاندازند.
[h=1]مکانیسم عمل آنتی ژنها [/h]هنگامی که آنتی ژن بیگانه وارد بدن میشود به سرعت از راه بافت لنفاوی در خون نفوذ کرده و سرانجام بوسیله ماکروفاژها از گردش خون خارج میگردد. در درون ماکروفاژها انواع مولکولهای درشت و ذرات بلعیده شده به کمک آنزیمها به مولکولهای آنتی ژنیک کوچک تبدیل میشوند. این مولکولها خود را به سلولهای سازنده آنتیکور میرسانند ماکروفاژها خود قدرت تولید آنتیکور را ندارند ولی غالبا در پاسخهای آنتی کوری نقشی به عهده دارند زیرا آنها آنتی ژنها را آماده کرده و آنگاه آنها رابه لنفوسیتهای واکنشگر معرفی میکنند. آنتی کورهای تولید شده وارد جریان خون شده و واکنشهای دستگاه ایمنی را بکار میاندازند.
[h=1]واکنش آگلوتینه شدن [/h]از لحاظ اصول واکنش آگلوتینه شدن به واکنش راسب شدن شباهت دارد. ولی در واکنش آگلوتینه شدن آنتی ژن به جای محلول بودن به صورت ذرهای است لذا تودههای بزرگتری از ترکیب آنتی ژن-آنتیکور پیدا میشود. آگلوتینه شدن و راسب شدن در بدن به زدودن آنتی ژن از خون کمک میکند. زیرا مواد آگلوتینه شده یا کمپلکسهای درشت آنتی ژن - آنتی کور نسبت به ذرات تک تک آنتی ژن یا مولکولهای آن سریعتر و بهتر بوسیله فاگوسیتها گرفته میشوند + نوشته شده در پنجشنبه هجدهم مهر 1387ساعت توسط سیامک علی حیدری | آرشیو نظرات
[h=2][/h][h=1]نگاه کلی [/h]انسان در محیطی زندگی میکند که عوامل و میکروارگانیسمهای بیماریزای متعددی سلامتی وی را بطور دائم تهدید میکند. پوست و پردههای مخاطی به نوان یک سد حفاظتی از ورود این عوامل به بدن جلوگیری مینمایند. با وجود این ، عبور عوامل بیماریزا از نواحی آسیب دیده و ضعیف این سد حفاظتی امکان پذیر میباشد.
بدن برای مقابله با عوامل بیماریزا مجهز به سیستم دفاعی یا ایمنی است که از نظر عملکردی آنرا به دو نوع : سیستم ایمنی طبیعی و سیستم ایمنی اکتسابی میتوان تقسیم کرد. عوامل عملکردی سیستم ایمنی یا دفاعی بدن عبارتند از : فاگوسیتها ، لنفوسیتها و سلولهای عرضه کننده آنتی ژن.
[h=2][/h][h=1]نگاه کلی [/h]انسان در محیطی زندگی میکند که عوامل و میکروارگانیسمهای بیماریزای متعددی سلامتی وی را بطور دائم تهدید میکند. پوست و پردههای مخاطی به نوان یک سد حفاظتی از ورود این عوامل به بدن جلوگیری مینمایند. با وجود این ، عبور عوامل بیماریزا از نواحی آسیب دیده و ضعیف این سد حفاظتی امکان پذیر میباشد.

|
| مکانیسم کار لنفوسیت B |
بدن برای مقابله با عوامل بیماریزا مجهز به سیستم دفاعی یا ایمنی است که از نظر عملکردی آنرا به دو نوع : سیستم ایمنی طبیعی و سیستم ایمنی اکتسابی میتوان تقسیم کرد. عوامل عملکردی سیستم ایمنی یا دفاعی بدن عبارتند از : فاگوسیتها ، لنفوسیتها و سلولهای عرضه کننده آنتی ژن.
[h=1]فاگوسیتها [/h]شامل ماکروفاژهای بافت همبند ، سلولهای کوپفر کبد ، ماکروفاژهای آلوئلی ریه ، میکروگلیهای بافت عصبی ، لکوسیتهای پلی مورنونوکلئر و مونوسیتهای خونی میباشد که در مجموع سیستمی را بوجود میآورند که اصطلاحا سیستم ایمنی طبیعی نامیده میشود. عملکرد فاگوسیتها به این ترتیب است که پس از نفوذ میکروارگانیسم از سطوح اپیتلیال و ورود آن به بدن ، ترشح عوامل واسطهای توسط سلولهای آسیب دیده ، سبب بروز واکنش التهابی و جلب فاگوسیتها به محل آسیب میگردد. در محل آسیب ، فاگوسیتها تحت تاثیر عاملی به نام فاکتور کموتاکسی به طرف میکروارگانیسمها کشیده شده و پس از چسبیدن به میکروارگانیسمها ، آنها را فاگوسیته مینمایند.
[h=1]نحوه عملکرد ماکروفاژها به عنوان فاگوسیت اصلی بدن [/h]ماکروفاژها پس از فاگوسیته کردن میکروارگانیسم ، مولکول آنتی ژنیک آن را حفظ کرده و باظاهر ساختن آن در سطح خود به عنوان یک معرفی کننده آنتی ژن آن را به لنفوسیتها عرضه میکنند. این عمل که باعث فعال شدن لنفوسیتها میشود چگونگی ارتباط بین عوامل عملکردی سیستم ایمنی را نشان میدهد. علاوه بر اعمال فوق ، سایر فعالیتهای ماکروفاژها عبارتند از: سنتز و ترشح تعدادی از پروتئینهای سیستم کمپلمان ، ترشح عوامل فعال کننده رشد و تکثیر لنفوسیتها و سایر سلولها و تولید عوامل کشنده باکتریها و سلولهای توموری.
[h=1]نحوه عملکرد ماکروفاژها به عنوان فاگوسیت اصلی بدن [/h]ماکروفاژها پس از فاگوسیته کردن میکروارگانیسم ، مولکول آنتی ژنیک آن را حفظ کرده و باظاهر ساختن آن در سطح خود به عنوان یک معرفی کننده آنتی ژن آن را به لنفوسیتها عرضه میکنند. این عمل که باعث فعال شدن لنفوسیتها میشود چگونگی ارتباط بین عوامل عملکردی سیستم ایمنی را نشان میدهد. علاوه بر اعمال فوق ، سایر فعالیتهای ماکروفاژها عبارتند از: سنتز و ترشح تعدادی از پروتئینهای سیستم کمپلمان ، ترشح عوامل فعال کننده رشد و تکثیر لنفوسیتها و سایر سلولها و تولید عوامل کشنده باکتریها و سلولهای توموری.
[h=1]اپسونین و اپسونیزاسیون [/h]فاگوسیتوز میکروارگانیسمها و سایر آنتی ژنها در اثر اپسونیزاسیون یعنی پوشیده شدن آنها توسط پروتئینهای ویژهای به نام اپسونین تسهیل و تسریع میگردد. اپسونینها شامل کمپلمان و آنتی بادیها میباشند. کمپلمانها به دسته بزرگی از پروتئینهای موجود در سرم خون اطلاق میگردد که از حدود 20 پروتئین مختلف تشکیل شدهاند و به سیستم کمپلمان مشهورند.
این پروتئینها که توسط ماکروفاژها و کبد سنتز میگردند با حرف C و یک پسوند عددی مثل
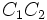 نمایش داده میشود. علت نامگذاری این پروتئینها به عنوان مکمل ، چگونگی عملکرد آنهاست که تکمیل کننده عمل آنتی بادیها میباشند به این معنی که کمپلمان ، با اتصال به آنتی بادی چسبیده به آنتی ژن ، فعال شده و خاصیت پروتئولیتیک پیدا میکند و یا باعث اتصال آن به فاگوسیتها میگردد. سیستم کمپلمان به دو طریق فعال میگردد.
نمایش داده میشود. علت نامگذاری این پروتئینها به عنوان مکمل ، چگونگی عملکرد آنهاست که تکمیل کننده عمل آنتی بادیها میباشند به این معنی که کمپلمان ، با اتصال به آنتی بادی چسبیده به آنتی ژن ، فعال شده و خاصیت پروتئولیتیک پیدا میکند و یا باعث اتصال آن به فاگوسیتها میگردد. سیستم کمپلمان به دو طریق فعال میگردد.
این پروتئینها که توسط ماکروفاژها و کبد سنتز میگردند با حرف C و یک پسوند عددی مثل
- توسط کمپلکس آنتی ژن - آنتی بادی که مسیر کلاسیک نامیده میشود.
- توسط عوامل عفونی که مسیر فرعی نامیده میشود.
ایمنی حاصله توسط لنفوسیتها در مقایسه با ایمنی طبیعی کاملا اختصاصی بوده و مصونیتزا میباشد. منظور اینکه ابتلا به یک بیماری عفونی باعث میشود بدن در مقابل آن برای مدتی مصونیت پیدا کند. سلولهای لنفوسیت B و T عوامل اجرایی سیستم ایمنی اکتسابی میباشند.
ایمنی اکتسابی حاصله توسط لنفوسیتهای B را ایمنی هومورال مینامند که بدن را در مقابل عوامل مهاجم و بیماریزا محافظت میکند. در حالی که ، ایمنی حاصله توسط لنفوسیتهای T را ایمنی با واسطه سلولی مینامند. که عهدهدار شناسایی و نابود کردن سلولهای غیر طبیعی میباشد. با وجود این تقسیم بندی فوق مطلق نمیباشد و در موارد متعددی پاسخهای ایمنی هومورال و با واسطه سلولی باهم تداخل دارند.
[h=1]ایمنی هومورال [/h]وابسته به لنفوسیت B و تولید آنتی بادی توسط آنها میباشد. لنفوسیتهای B پس از تشکیل و مهاجرت به اعضای لنفاوی ، در صورت عدم مواجه شدن با آنتی ژن فعال شده و سپس تحت تاثیر فاکتورهای مترشحه از لنفوسیتهای T ، تکثیر و تمایز یافته و سلولهای یادگار و پلاسماسلهای تولید کننده آنتی بادیها را بوجود میآورند.
پلاسماسلها بلافاصله شروع به سنتز و ترشح آنتی بادی نموده و پاسخ ایمنی اولیه را سبب میشوند، سلولهای خاطرهدار ، دارای عمری طولانی بوده و در ضمن گردش در لنف و اعضای لنفی ، در صورت مواجهه مجدد با همان نوع آنتی ژن سریعا عکس
انواع ایمنی در بدن
ایمنی اکتسابی حاصله توسط لنفوسیتهای B را ایمنی هومورال مینامند که بدن را در مقابل عوامل مهاجم و بیماریزا محافظت میکند. در حالی که ، ایمنی حاصله توسط لنفوسیتهای T را ایمنی با واسطه سلولی مینامند. که عهدهدار شناسایی و نابود کردن سلولهای غیر طبیعی میباشد. با وجود این تقسیم بندی فوق مطلق نمیباشد و در موارد متعددی پاسخهای ایمنی هومورال و با واسطه سلولی باهم تداخل دارند.
[h=1]ایمنی هومورال [/h]وابسته به لنفوسیت B و تولید آنتی بادی توسط آنها میباشد. لنفوسیتهای B پس از تشکیل و مهاجرت به اعضای لنفاوی ، در صورت عدم مواجه شدن با آنتی ژن فعال شده و سپس تحت تاثیر فاکتورهای مترشحه از لنفوسیتهای T ، تکثیر و تمایز یافته و سلولهای یادگار و پلاسماسلهای تولید کننده آنتی بادیها را بوجود میآورند.
پلاسماسلها بلافاصله شروع به سنتز و ترشح آنتی بادی نموده و پاسخ ایمنی اولیه را سبب میشوند، سلولهای خاطرهدار ، دارای عمری طولانی بوده و در ضمن گردش در لنف و اعضای لنفی ، در صورت مواجهه مجدد با همان نوع آنتی ژن سریعا عکس
[h=1]آنتی بادیها یا ایمونوگلوبولینها [/h]پروتئینهایی هستند که توسط پلاسماسلها بطور اختصاصی بر علیه آنتی ژنهای وارده به بدن سنتز و ترشح میگردند و با اتصال به آنتی ژن زمینه انهدام آن را فراهم میسازند. آنتی ژن ممکن است ویروس ، باکتری ، قارچ ، انگل ، پروتئین یا پلی ساکارید باشد، آنتی بادی قابل اتصال به همه قسمتهای آنتی ژن نمیباشد.
[h=1]ایمنی باواسطه سلولی [/h]ایمنی باواسطه سلولی به ایمنی حاصله از لنفوسیتهای T اطلاق میگردد که بدون ترشح آنتی بادی انجام میگیرد و مسئول شناسایی و انهدام سلولهای غیر طبیعی میباشد. منظور از سلولهای غیر طبیعی سلولهایی هستند که تحت تاثیر عوامل مختلف پروتئینهایی را سنتز میکنند که با بسته شدن به مولکول MHC و ظهور در سطح سلول ، توسط لنفوسیتهای T قابل شناسایی میگردند. لنفوسیتهای T به سه دسته کمک کننده ، سرکوبگر یا مهارکننده و سیتوکسیک تقسیم میشوند.
عملکرد T-cell کمک کننده در ارتباط با ایمنی هومورال میباشد. T-cellهای مهارکننده فعالیت سلولهای تولید کننده آنتی بادی و سیتوتوکسیک را مهار نموده و در تنظیم فعالیت این سلولها اهمین بسزایی دارند. T-cellهای سیتوتوکسیک یا کشنده به T-cellهای عمل کننده نیز موسومند و در واقع واکنش ایمنی سلولی را عهدهدار میباشند و در شناسایی و انهدام سلولهای آلوده به ویروس ، سلولهای آلوده به باکتری و انگلهای داخلی سلولی و همچنین سلولهای تغییر یافته سرطانی و سلولهای تغییر یافته در اثر مواد شیمیایی نقش دارند.
[h=1]بافتها و اعضای لنفی [/h]
[h=1]ایمنی باواسطه سلولی [/h]ایمنی باواسطه سلولی به ایمنی حاصله از لنفوسیتهای T اطلاق میگردد که بدون ترشح آنتی بادی انجام میگیرد و مسئول شناسایی و انهدام سلولهای غیر طبیعی میباشد. منظور از سلولهای غیر طبیعی سلولهایی هستند که تحت تاثیر عوامل مختلف پروتئینهایی را سنتز میکنند که با بسته شدن به مولکول MHC و ظهور در سطح سلول ، توسط لنفوسیتهای T قابل شناسایی میگردند. لنفوسیتهای T به سه دسته کمک کننده ، سرکوبگر یا مهارکننده و سیتوکسیک تقسیم میشوند.
عملکرد T-cell کمک کننده در ارتباط با ایمنی هومورال میباشد. T-cellهای مهارکننده فعالیت سلولهای تولید کننده آنتی بادی و سیتوتوکسیک را مهار نموده و در تنظیم فعالیت این سلولها اهمین بسزایی دارند. T-cellهای سیتوتوکسیک یا کشنده به T-cellهای عمل کننده نیز موسومند و در واقع واکنش ایمنی سلولی را عهدهدار میباشند و در شناسایی و انهدام سلولهای آلوده به ویروس ، سلولهای آلوده به باکتری و انگلهای داخلی سلولی و همچنین سلولهای تغییر یافته سرطانی و سلولهای تغییر یافته در اثر مواد شیمیایی نقش دارند.
[h=1]بافتها و اعضای لنفی [/h]
برای اینکه سیستم ایمنی بتواند وظایف خود را به نحو مطلوب انجام دهد، سلولهای دخیل در پاسخهای ایمنی به صورت بافتها و اعضای سازمان دهی شدهاند. مجموعه این بافتها و اعضای سیستم لنفی نیز نامیده میشوند.
[h=2]بافتهای لنفاوی [/h]شامل ندولهای لنفاوی میباشد که در همه اعضای لنفاوی به جز تیموس و یا به صورت مستقل در بافت همبند آستر و زیر مخاط دستگاههای گوارشی ، تنفسی و تناسلی دیده میشوند. که ندولها به دو صورت اولیه و ثانویه دیده میشوند که در ندولهای اولیه تراکم سلولها یکنواخت میباشد ولی ندولهای ثانویه دارای یک ناحیه متراکم و تیره محیطی و یک ناحیه کم تراکم روشن و مرکزی میباشند.
[h=2]اعضای لنفاوی [/h]به دو دسته اولیه و ثانویه تقسیم میگردند که اعضای لنفاوی اولیه شامل مغز استخوان و تیموس میباشد که محل تمایز لنفوسیتها هستند و اعضای لنفاوی ثانویه شامل عقدههای لنفی ، طحال ، رودهها ، پلاکهای پییر میباشد که محل استقرار لنفوسیتهای تمایز یافته میباشند. لوزهها نیز اجتماعی از ندولهای دارای مرکز زایا و بافت لنفاوی منتشر میباشند که به صورت حلقهای در ابتدای لوله گوارش قرار گرفتهاند.
[h=2]بافتهای لنفاوی [/h]شامل ندولهای لنفاوی میباشد که در همه اعضای لنفاوی به جز تیموس و یا به صورت مستقل در بافت همبند آستر و زیر مخاط دستگاههای گوارشی ، تنفسی و تناسلی دیده میشوند. که ندولها به دو صورت اولیه و ثانویه دیده میشوند که در ندولهای اولیه تراکم سلولها یکنواخت میباشد ولی ندولهای ثانویه دارای یک ناحیه متراکم و تیره محیطی و یک ناحیه کم تراکم روشن و مرکزی میباشند.
|
| بافت لنفاوی |
[h=2]اعضای لنفاوی [/h]به دو دسته اولیه و ثانویه تقسیم میگردند که اعضای لنفاوی اولیه شامل مغز استخوان و تیموس میباشد که محل تمایز لنفوسیتها هستند و اعضای لنفاوی ثانویه شامل عقدههای لنفی ، طحال ، رودهها ، پلاکهای پییر میباشد که محل استقرار لنفوسیتهای تمایز یافته میباشند. لوزهها نیز اجتماعی از ندولهای دارای مرکز زایا و بافت لنفاوی منتشر میباشند که به صورت حلقهای در ابتدای لوله گوارش قرار گرفتهاند.
[h=1]پیوند بافتها [/h]امروزه پیوند بافتها ، راهی مناسب برای ترمیم بافتهای آسیب دیده غیر قابل ترمیم ارگانهای از کار افتاده میباشد. پیوند بافت به چند صورت امکان پذیر است:
- Autograft: در این حالت برای پیوند از بافتهای بدن خود فرد استفاده میشود.
- Isograft: حالتی است که در آن پیوند بین دو فرد که از نظر ژنتیکی یکسان هستند، انجام میگیرد مانند پیوند دوقلوهای یک تخمه.
- Allograft: در این حالت پیوند بین دو فرد که از لحاظ ژنتیکی با یکدیگر متفاوت هستند صورت میگیرد که معمولترین پیوند در پزشکی محسوب میشود.
- Hetrograft: حالتی است که در آن بافت پیوندی برای انسان از یک حیوان تهیه میشود.
كولونوسكوپی: كولونوسكوپی روش ارجح و پیشنهادی برای غربالگری است. كولونوسكوپی یعنی بررسی روده توسط کولونوسکوپ(لوله قابل انعطافی که به داخل بدن فرستاده می شود و پزشک توسط آن می تواند داخل روده را ببیند).حساسیت آن برای پولیپهای بزرگ تر از یك سانتیمتر بالای 90 درصد است و تنها پولیپهایی كه در بین چینها یا در موقعیت آناتومیك خاصی قرار داشته باشند، ممكن است از دید پزشك در امان بمانند. در این روش علاوه برردیابی ضایعات امكان برداشتن ضایعه نیز میسر است و در واقع هم یك روش تشخیصی و هم درمانی است و بعد از سن 50 سالگی، هر 10سال یك بار در همه افراد توصیه می شود.
كولونوسكوپی با امكان رؤیت تمام روده، مشاهده پولیپ و برداشتن آن توانسته در میزان مرگ و میر و ابتلای به سرطان روده تأثیر بارزی بگذارد. سیگموئیدوسكوپی، مهم ترین عارضه كولونوسكوپی سوراخ شدگی است، كه حدود 2/0درصد موارد را شامل می شود (دو برابر موارد سیگموئیدوسكوپی). بیماریهای همراه و سن بالای بیمار احتمال این عارضه را بالاتر می برد. این روش نسبتاً گران بوده و به آمادگی كامل روده نیازمند است. از آنجا كه حین بررسی، تجویز داروهای مسكن و آرام بخش به بیمار ضروری است، بیمار بعد از كولونوسكوپی قادر به انجام فعالیتهای روزانه نیست و باید استراحت كند.
[h=2]*كولونوسكوپی مجازی:[/h] كولونوسكوپی مجازی بعد از اقدامات آمادگی روده و تزریق هوا با دستگاه Spiral CT scan انجام شده و امكان مشاهده تمام مخاط روده را به صورت دو بُعدی و سه بُعدی میسر می كند. حساسیت آن در مطالعات مختلف بسیار متفاوت برآورد شده و در مجموع به نظر می رسد حساسیتی تقریباً نزدیك به كولونوسكوپی داشته باشد.
احساس ناراحتی بیماران در این روش نسبت به كولونوسكوپی اپتیكال كمتر بوده، احتیاج به داروهای مسكن ندارد و عوارض آن نیز كمتر است. همچنین انجام آن در زمان بسیار كمتری مقدور است. منتها كلیه بیمارانی كه در آنها ضایعهای یافت شود، باید متعاقباً تحت بررسی بیشتر با كولونوسكوپی اپتیكال قرار بگیرند. با این حال این روش هنوز به عنوان یك روش غربالگری توصیه نمی شود، چراكه احتیاج به اقدامات آمادگی دقیق روده دارد، بسیار گران است، در همه جا در دسترس نیست و همچنین اكثر پزشكان هنوز مهارت تفسیر نتایج آن را ندارند.
كولونوسكوپی با امكان رؤیت تمام روده، مشاهده پولیپ و برداشتن آن توانسته در میزان مرگ و میر و ابتلای به سرطان روده تأثیر بارزی بگذارد. سیگموئیدوسكوپی، مهم ترین عارضه كولونوسكوپی سوراخ شدگی است، كه حدود 2/0درصد موارد را شامل می شود (دو برابر موارد سیگموئیدوسكوپی). بیماریهای همراه و سن بالای بیمار احتمال این عارضه را بالاتر می برد. این روش نسبتاً گران بوده و به آمادگی كامل روده نیازمند است. از آنجا كه حین بررسی، تجویز داروهای مسكن و آرام بخش به بیمار ضروری است، بیمار بعد از كولونوسكوپی قادر به انجام فعالیتهای روزانه نیست و باید استراحت كند.
[h=2]*كولونوسكوپی مجازی:[/h] كولونوسكوپی مجازی بعد از اقدامات آمادگی روده و تزریق هوا با دستگاه Spiral CT scan انجام شده و امكان مشاهده تمام مخاط روده را به صورت دو بُعدی و سه بُعدی میسر می كند. حساسیت آن در مطالعات مختلف بسیار متفاوت برآورد شده و در مجموع به نظر می رسد حساسیتی تقریباً نزدیك به كولونوسكوپی داشته باشد.
احساس ناراحتی بیماران در این روش نسبت به كولونوسكوپی اپتیكال كمتر بوده، احتیاج به داروهای مسكن ندارد و عوارض آن نیز كمتر است. همچنین انجام آن در زمان بسیار كمتری مقدور است. منتها كلیه بیمارانی كه در آنها ضایعهای یافت شود، باید متعاقباً تحت بررسی بیشتر با كولونوسكوپی اپتیكال قرار بگیرند. با این حال این روش هنوز به عنوان یك روش غربالگری توصیه نمی شود، چراكه احتیاج به اقدامات آمادگی دقیق روده دارد، بسیار گران است، در همه جا در دسترس نیست و همچنین اكثر پزشكان هنوز مهارت تفسیر نتایج آن را ندارند.
[h=1]عطسه و نور [/h]مکانیزم ایجاد عطسه بین همه مردم جهان یکسان نیست بطوری که تنها 25 درصد مردم جهان هنگام نگاه به خورشید یا روشنایی زیاد ، عطسه میکنند که این عکسالعمل را عکسالعمل عطسه آور نسبت به نور گویند. دانشمندان در این مورد نظریات مختلفی دارند. بر اساس یکی از معروفترین نظریهها ، عصب جمجمهای عامل عطسه ، با طریقی عصب بینایی (Optic) مرتبط است. زمانی که عصب بینایی به شدت تحریک شد، منقبض میشود. و این فرایند بر عصب جمجمهای عطسه اثر گذاشته و موجب عطسه کردن میگردد.
برخی محققان عقیده دارند افرادی که آلرژی دارند استعداد بیشتری نسبت به عطسه در مقابل نور دارند. در یک بررسی وقتی آلرژی آنها درمان شد، عطسه آنها در مقابل نور کاسته میشود. نظریه دیگر ، حاکی از آن است که نور ، عصبهای صورت را تحریک و در پی آن مخاط غشای بینی تحریک شده و عطسه اتفاق میافتد. در آخر ، اگر چه هر کس به درستی نمیداند نور خورشید چرا سبب عطسه میشود ولی به نظر میرسد این حالت بدون هیچ سود و زیانی برای فرد باشد.
برخی محققان عقیده دارند افرادی که آلرژی دارند استعداد بیشتری نسبت به عطسه در مقابل نور دارند. در یک بررسی وقتی آلرژی آنها درمان شد، عطسه آنها در مقابل نور کاسته میشود. نظریه دیگر ، حاکی از آن است که نور ، عصبهای صورت را تحریک و در پی آن مخاط غشای بینی تحریک شده و عطسه اتفاق میافتد. در آخر ، اگر چه هر کس به درستی نمیداند نور خورشید چرا سبب عطسه میشود ولی به نظر میرسد این حالت بدون هیچ سود و زیانی برای فرد باشد.
[h=1]عطسه و فشار آن [/h]به علت فشار بالای عطسه در پرتاب کردن ذرات از بینی جلوگیری از آن در برخی موارد به پارگی برخی عروق در سر یا گردن میانجامد و اگر شدت عطسه خیلی بالا باشد ممکن است یک دنده انسان را بشکند.
[h=1]عطسه و تعداد آن [/h]چنانچه تعداد عطسه در حد متعادل باشد، نیازی به پیشگیری از آن نیست و باید بدن را در کاربرد دستگاه دفاعی خود آزاد گذاشت . اما در صورتی که تعداد بالای عطسه باعث آزار فرد گردد باید با داروهای ضد حساسیت آن را درمان کرد چرا که یکی از علایم حاصل از آلرژی ، عطسه میباشد. عطسههای پیاپی و پشت سر هم معمولا نشانه وجود آلرژی است اما تک عطسه معمولا نشانه سرماخوردگی است. به علاوه در سرماخوردگی به ترشحات بینی ، زرد رنگ است، در صورتی که در آلرژی ترشحات بینی ، بیرنگ و رقیق میباشد.
[h=1]حدیث و دعا در رابطه با عطسه [/h]به نقل از خدمتکار حضرت حجت "عج" آمدده است که آنحضرت به ایشان فرمود: "آیا تو را در مورد عطسه کردن بشارت بدهم؟" گفتم: آری. فرمود: "عطسه علامت امان از مرگ تا سه روز است". نیز در روایات آمده است بعد از عطسه ، انگشت روی بینی گذاشته و دعای زیر را بخوانید: الحمد...رب العمالمین علی کل حال انی امنت برتکم فاسمعون الحمدالله رب العالمین.
[h=1]عطسه و تعداد آن [/h]چنانچه تعداد عطسه در حد متعادل باشد، نیازی به پیشگیری از آن نیست و باید بدن را در کاربرد دستگاه دفاعی خود آزاد گذاشت . اما در صورتی که تعداد بالای عطسه باعث آزار فرد گردد باید با داروهای ضد حساسیت آن را درمان کرد چرا که یکی از علایم حاصل از آلرژی ، عطسه میباشد. عطسههای پیاپی و پشت سر هم معمولا نشانه وجود آلرژی است اما تک عطسه معمولا نشانه سرماخوردگی است. به علاوه در سرماخوردگی به ترشحات بینی ، زرد رنگ است، در صورتی که در آلرژی ترشحات بینی ، بیرنگ و رقیق میباشد.
[h=1]حدیث و دعا در رابطه با عطسه [/h]به نقل از خدمتکار حضرت حجت "عج" آمدده است که آنحضرت به ایشان فرمود: "آیا تو را در مورد عطسه کردن بشارت بدهم؟" گفتم: آری. فرمود: "عطسه علامت امان از مرگ تا سه روز است". نیز در روایات آمده است بعد از عطسه ، انگشت روی بینی گذاشته و دعای زیر را بخوانید: الحمد...رب العمالمین علی کل حال انی امنت برتکم فاسمعون الحمدالله رب العالمین.
[h=1]خرافات و عطسه [/h]مردم مختلف در حدود عطسه ، عقاید مختلفی دارند. برخی ، به محض عطسه فال حافظ یا استخاره قرآن را انجام میدهند. برخیها لفظا میگویند صبر آمد و کار خود را متوقف میکنند و اگر موقع بیرون رفتن باشد، حتی ممکن است به خانه برگردند. یا کفشهای خود را نگه به لنگه بپوشند، یا در کفشهای خود نمک بریزند اما همه این اعمال به خاطر چیست؟ به این خاطر است که مردم در مورد عطسه خاطره چندان خوشی ندارند.
مثلا آیا شنیدهاند کسی در هنگام عبور از خیابان عطسه کرد و همین موجب تصادف او گردید، یا اینکه آیا برایتان اتفاق افتاده وقتی دستتان چایی است عطسه کرده و چایی رویتان و موجب سوختن شما شود. اینها و هزاران مورد دیگر ، از جمله مواردی هستند که اکثر مردم به عطسه و نتایج آن ، به دید منفی نگاه کنند و عطسه بیشتر از آنکه آرامش دهنده و به عنوان یک سیستم دفاعی بدن باشد بلای جان بشر میشود.
[h=1]چشم انداز حبث [/h]با در نظر گرفتن نتایج علمی کنونی در صدد مکانیسمهای دفاعی بدن و از آن جمله عطسه ، اعتقاد به خرافات مساله واهی به نظر میرسد اما این عقیده حتی در بین افراد با تحصیلات بالا ، نیز وجود دارد. اما احتمال این میرود که در آینده از اعتقاداتی همچون وقتگیر و دست و پا گیر ، کاسته شود و جای خود را به توجیهات علمی بدهد.
برگرفته از : دانشنامه رشد
مثلا آیا شنیدهاند کسی در هنگام عبور از خیابان عطسه کرد و همین موجب تصادف او گردید، یا اینکه آیا برایتان اتفاق افتاده وقتی دستتان چایی است عطسه کرده و چایی رویتان و موجب سوختن شما شود. اینها و هزاران مورد دیگر ، از جمله مواردی هستند که اکثر مردم به عطسه و نتایج آن ، به دید منفی نگاه کنند و عطسه بیشتر از آنکه آرامش دهنده و به عنوان یک سیستم دفاعی بدن باشد بلای جان بشر میشود.
[h=1]چشم انداز حبث [/h]با در نظر گرفتن نتایج علمی کنونی در صدد مکانیسمهای دفاعی بدن و از آن جمله عطسه ، اعتقاد به خرافات مساله واهی به نظر میرسد اما این عقیده حتی در بین افراد با تحصیلات بالا ، نیز وجود دارد. اما احتمال این میرود که در آینده از اعتقاداتی همچون وقتگیر و دست و پا گیر ، کاسته شود و جای خود را به توجیهات علمی بدهد.
برگرفته از : دانشنامه رشد
گیاه شناسی
کاربر بیش فعال
ممنون از این مطلب
[h=2]الایزا[/h]
« الايزا »
در ابتدای نيمه ی قرن بيستم ، محصول ايمنی همورال يعنی آنتی بادی ها يکی از نقاط عطف در مقوله ی روش های سنجش را بوجود آوردند . آنتی باديها با اتصال ويژه به آناليتی که بر ضد آنها تهيه شده اند ، به عنوان ابزاری مناسب برای سنجش های ويژه و سريع در اختيار محققان قرار گرفتند . روش هايی که از آنتی باديها به عنوان فاکتور شناساگر بهره می گيرند ، روش های سنجش ايمنی نام دارند .
تمامی سنجش های ايمنی که بر اساس واکنش تعادلی و غير کووالانسی بين ايمونوگلوبولين و آناليت ها بنا شده اند ، در اصل از مهمترين روش های سنجش اتصال ليگاند به شمار می آيند . بر هم کنش آنتی بادی با آناليت عمدتاً از نوع هيدروژنی و واندروالس است . اين بر هم کنش ناشی از مکمل بودن شکل فضايی ناحيه متغير آنتی بادی با بخشی از ساختمان آناليت می باشد . اغلب ، آنتی بادی های پلی کلونالی که در سنجش های ايمنی بکار می روند از نوع IgG هستند .
بر هم کنش ميان آناليت و آنتی بادی فيزيکی است ، يعنی تغيير شيميايی در ساختمان آناليت يا آنتی بادی بوجود نمی آيد . به هر حال واکنش ويژه ميان آناليت و آنتی بادی اساس کليه روش های سنجش ايمنی می باشد . به منظور رديابی واکنش مذبور از سيگنال دهنده های مختلفی بهره گرفته اند . مثلاًاستفاده از ماده ی راديو اکتيو سنجش های RIA ، IRMA و استفاده از سيگنال دهنده های آنزيمی سنجش های EIA ، IEMA را بوجود آورده است .
« الايزا »
در ابتدای نيمه ی قرن بيستم ، محصول ايمنی همورال يعنی آنتی بادی ها يکی از نقاط عطف در مقوله ی روش های سنجش را بوجود آوردند . آنتی باديها با اتصال ويژه به آناليتی که بر ضد آنها تهيه شده اند ، به عنوان ابزاری مناسب برای سنجش های ويژه و سريع در اختيار محققان قرار گرفتند . روش هايی که از آنتی باديها به عنوان فاکتور شناساگر بهره می گيرند ، روش های سنجش ايمنی نام دارند .
تمامی سنجش های ايمنی که بر اساس واکنش تعادلی و غير کووالانسی بين ايمونوگلوبولين و آناليت ها بنا شده اند ، در اصل از مهمترين روش های سنجش اتصال ليگاند به شمار می آيند . بر هم کنش آنتی بادی با آناليت عمدتاً از نوع هيدروژنی و واندروالس است . اين بر هم کنش ناشی از مکمل بودن شکل فضايی ناحيه متغير آنتی بادی با بخشی از ساختمان آناليت می باشد . اغلب ، آنتی بادی های پلی کلونالی که در سنجش های ايمنی بکار می روند از نوع IgG هستند .
بر هم کنش ميان آناليت و آنتی بادی فيزيکی است ، يعنی تغيير شيميايی در ساختمان آناليت يا آنتی بادی بوجود نمی آيد . به هر حال واکنش ويژه ميان آناليت و آنتی بادی اساس کليه روش های سنجش ايمنی می باشد . به منظور رديابی واکنش مذبور از سيگنال دهنده های مختلفی بهره گرفته اند . مثلاًاستفاده از ماده ی راديو اکتيو سنجش های RIA ، IRMA و استفاده از سيگنال دهنده های آنزيمی سنجش های EIA ، IEMA را بوجود آورده است .
اساس روش های سنجش ايمنی شناسايی آناليت ، اولين مرحله در اين نوع سنجش محسوب می شود . اين عمل توسط آنتی بادی انجام می پذيرد . به عبارتی ، جزء لا ينفک هر سنجش ايمنی واکنش ميان آنتی ژن و آنتی بادی است . در محدوده ی معينی از غلظت آنتی ژن و آنتی بادی انجام واکنش منجر به تشکيل رسوب قابل رويت ( قبل يا بعد از رنگ آميزی ) می گردد . اما در اغلب موارد ، قبل و بعد از انجام واکنش آنتی ژن و آنتی بادی تغيير قابل مشاهده ای وجود ندارد ، به همين دليل وجود سيستم نشانه گذاری ضروری به نظر می رسد . نوع طبقه بندی سنجش های ايمنی آنزيمی بر اساس نوع نشاندار سازی است . همانطو که اشاره شد در اين روش نيز می توان جهت رديابی واکنش ، آنتی ژن و ِيا آنتی بادی را با آنزيم نشاندار ساخت . به عمل نشاندار سازی ، کونژوگاسيون و به مولکول آنزيم دار ، کونژوگه ی آنزيمی نيز می گويند . چنانچه آنتی ژن کونژوگه گردد روش را EIA ( Enzyme Immuno Assay ) گويند و اگر آنتی بادی کونژوگه گردد روش را IEMA ( Immuno Enzymo Meteric Assay ) می نامند .اساس روش EIA ، رقابت ميان آنتی ژن کونژوگه و آنتی ژن آزاد در نمونه مورد سنجش بر سر اتصال به آنتی بادی است . در اينجا ميزان کمپلکس آنزيم دار با آنتی ژن آزاد رابطه معکوس دارد . لذا می توان بسته به نياز آنتی بادی های پلی و يا مونو کلونال استفاده کرد . البته در برخی سنجش ها آنتی بادی های اليگو کلونال پاسخ بهتری ايجاد می کنند . چنانچه چند نوع آنتی بادی مونو کلونال را با هم مخلوط کنيم ، مجموعه حاصله را آنتی بادی اليگو کلونال می نامند
مزايای IEMA نسبت به EIA : 1- سادگی نشان دار کردن 4 – سرعت بيشتر واکنش 2 - افزايش حساسيت 5 – محدوده ی وسيع تر از غلظت آناليت3 - ويژگی بالاتر 6 – مقاومت بيشتر در برابرشرايط آزمايش اجازه دهيد به برخی از مزايای روش های سنجش ايمنی آنزيم دار نسبت به سنجش ايمنی راديو اکتيو اشاره ای داشته باشيم : 1 – عدم وجود خطر تشعشع 5 – امکان اتوماسيون2 – قيمت ارزانتر دستگاه ها 6 – سرعت خوانش بالا 3 – معرف های ارزان 7 – امکان افزايش حساسيت روش 4 – نيمه عمر طولانی کيت های آنزيمی شايد اولين گزارش در مورد تداخل در سنجش ايمنی در مورد هپاتيت B توسط Sgouris مطرح شد . وی در سنجش آنتی ژن مذکور اغلب دچار خطای مثبت کاذب می شد . در اين تحقيق ، مشکل با افزايش سرم حاوی ايمونوگلوبولين های طبيعی حل شد . بهدنبال اين گزارش گروهی از محققان به بررسی عميق تداخلات در سنجش های ايمنی وو رفع آنها پرداختند. محققانی چون Kroli ، Elin ، Chapman سهم زيادی در اين زمينه داشته اند .
متغير ها قبل از سنجش
تمامی عواملی که قبل از انجام آزمايش و زمان انتخاب نوع نمونه ، شيوه نمونه گيری نگهداری و ارسال آن بر نتيجه سنجش تاثير داشته باشند را متغير های قبل از سنجش گويند
اين متغير ها بر دو نوع هستند:
1 – متغير های وابسته به بيمار 2 – متغير های وابسته به نمونه
توجه داشته باشيد که عواملی مانند زمان نامناسب نمونه گيری يا فاکتور های محيطی مانند سيگار کشيدن هر چند که آزمايش را تحت تاثير قرار می دهند اما به عنوان عامل مداخله گر نيستند .
محکم بستن يا طولانی شدن مدت تورنيکت بر روی وريدها باعث افزايش فشار و خروج مايعات از وريدها به فضای ميان بافتی گرديده ، غلظت برخی از آناليت ها را افزايش می دهد مثلاً اين شرايط باعث 5% افزايش در ميزان پروتئين فرد می شود و به تبع آنها ليگاندهای متصل به آنها نيز افزايش ميابد .
ماهيت نمونه : تقريباً تمام سنجش های ايمنی از سرم به عنوان نمونه مورد بررسی استفاده می کنند . در مواردی که بيمار نياز به آزمايشاتی مانند CBC دارد وجود پلاسما آزمايشگر را تشويق می کند تا از نمونه گيری مجدد پرهيز کند و از پلاسما به عنوان نمونه مورد سنجش استفاده نمايد . هر چند در اغلب سنجش های ايمنی تفاوتی ميان نتايج سرم و پلاسما وجود ندارد اما به هر حال با توجه به تفاوت زمينه ( Matrix ) اين دو نمونه ، اعتبار جايگزينی پلاسما به جای سرم بايد اثبات شده باشد .
استفاده از پلاسمايی که از ليتيم هپارين ( Li . Hep ) به عنوان ضد انعقاد در مورد آن استفاده شده در اکثر موارد قابل قبول است اما در مورد پلاسمايی که از EDTA به عنوان ضد انعقاد استفاده کرده اند بايد با احتياط بيشتری رفتار شود . آلودگی نمونه ها می تواند منشا خطا در سنجش باشد .
وجود غلظت های بالای هموگلوبين در نمونه های هموليز با بر هم کنش پروتئينی در به تعادل رسيدن واکنش آنتی ژن _ آنتی بادی تداخل ايجاد کرده ، زمان به تعادل رسيدن را افزايش می دهد .
اغلب آناليت ها پايداری خوبی دارند و حتی اگر گويچه های خونی از سرم جدا نشوند می توان بسته به نوع آناليت چند روز اين نمونه را در دمای 4 درجه سانتی گراد نگهداری نمود . به عنوان مثال هورمون های ، TSH ، FT4 ، PRL ، LH ، FSH و PSA در نمونه سرمی به مدت دو هفته در دمای 4 درجه سانتی گراد پايدار می مانند .
تمامی عواملی که قبل از انجام آزمايش و زمان انتخاب نوع نمونه ، شيوه نمونه گيری نگهداری و ارسال آن بر نتيجه سنجش تاثير داشته باشند را متغير های قبل از سنجش گويند
اين متغير ها بر دو نوع هستند:
1 – متغير های وابسته به بيمار 2 – متغير های وابسته به نمونه
توجه داشته باشيد که عواملی مانند زمان نامناسب نمونه گيری يا فاکتور های محيطی مانند سيگار کشيدن هر چند که آزمايش را تحت تاثير قرار می دهند اما به عنوان عامل مداخله گر نيستند .
- متغير های وابسته به نمونه
محکم بستن يا طولانی شدن مدت تورنيکت بر روی وريدها باعث افزايش فشار و خروج مايعات از وريدها به فضای ميان بافتی گرديده ، غلظت برخی از آناليت ها را افزايش می دهد مثلاً اين شرايط باعث 5% افزايش در ميزان پروتئين فرد می شود و به تبع آنها ليگاندهای متصل به آنها نيز افزايش ميابد .
ماهيت نمونه : تقريباً تمام سنجش های ايمنی از سرم به عنوان نمونه مورد بررسی استفاده می کنند . در مواردی که بيمار نياز به آزمايشاتی مانند CBC دارد وجود پلاسما آزمايشگر را تشويق می کند تا از نمونه گيری مجدد پرهيز کند و از پلاسما به عنوان نمونه مورد سنجش استفاده نمايد . هر چند در اغلب سنجش های ايمنی تفاوتی ميان نتايج سرم و پلاسما وجود ندارد اما به هر حال با توجه به تفاوت زمينه ( Matrix ) اين دو نمونه ، اعتبار جايگزينی پلاسما به جای سرم بايد اثبات شده باشد .
استفاده از پلاسمايی که از ليتيم هپارين ( Li . Hep ) به عنوان ضد انعقاد در مورد آن استفاده شده در اکثر موارد قابل قبول است اما در مورد پلاسمايی که از EDTA به عنوان ضد انعقاد استفاده کرده اند بايد با احتياط بيشتری رفتار شود . آلودگی نمونه ها می تواند منشا خطا در سنجش باشد .
وجود غلظت های بالای هموگلوبين در نمونه های هموليز با بر هم کنش پروتئينی در به تعادل رسيدن واکنش آنتی ژن _ آنتی بادی تداخل ايجاد کرده ، زمان به تعادل رسيدن را افزايش می دهد .
اغلب آناليت ها پايداری خوبی دارند و حتی اگر گويچه های خونی از سرم جدا نشوند می توان بسته به نوع آناليت چند روز اين نمونه را در دمای 4 درجه سانتی گراد نگهداری نمود . به عنوان مثال هورمون های ، TSH ، FT4 ، PRL ، LH ، FSH و PSA در نمونه سرمی به مدت دو هفته در دمای 4 درجه سانتی گراد پايدار می مانند .
Similar threads
| Thread starter | عنوان | تالار | پاسخ ها | تاریخ |
|---|---|---|---|---|
| Z | همه چیز را درباره بواسیر بدانید. | دانستنی های پزشکی | 0 | |
| Z | هر آنچه باید درباره پروتز سینه بدانید | دانستنی های پزشکی | 0 | |
| S | هر چی که درباره بیماری جدید سندروم روده می دانیم؟ | دانستنی های پزشکی | 0 | |
| S | همه چیز درباره پروتز سینه | دانستنی های پزشکی | 0 | |
| Z | همه چیز درباره واریکوسل | دانستنی های پزشکی | 0 |
Similar threads
-
-
-
هر چی که درباره بیماری جدید سندروم روده می دانیم؟
- شروع شده توسط shimanami
- پاسخ ها: 0
-
-
