جاوا اسکریپت غیر فعال است برای تجربه بهتر، قبل از ادامه، جاوا اسکریپت را در مرورگر خود فعال کنید.
You are using an out of date browser. It may not display this or other websites correctly.
You should upgrade or use an
alternative browser .
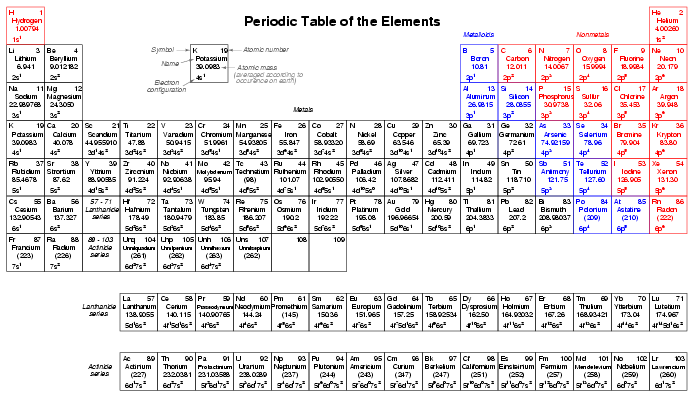
معرفی جامع عناصر جدول تناوبی
کاربر فعال تالار شیمی
کاربر ممتاز
اثرات بور در سلامتي انسان اثرات بور بر محيط زيست خواص فیزیکی و شیمیایی عنصر بور : ایزوتوپ : اشکال دیگر : منابع : کاریرد : آلومینیم ( Aluminum )
اثرات آلومينيم بر سلامتي انسان تجهیزات آزمایشگاهی مورد استفاده در تجزیه خواص فیزیکی و شیمیایی : ایزوتوپ : اشکال دیگر : منابع :
کاربر فعال تالار شیمی
کاربر ممتاز
اثرات گاليم بر سلامتي انسان اثرات زيست محيطي گاليم تجهیزات آزمایشگاهی مورد استفاده در تجزیه خواص فیزیکی و شیمیایی عنصر گالیم : ایزوتوپ : اشکال دیگر : منابع : ایندیم ( Indium )
اثرات ایندیم بر روی سلامتی اثرات زیست محیطی ایندیم تجهیزات آزمایشگاهی مورد استفاده در تجزیه خواص فیزیکی و شیمیایی عنصر ایندیم : ایزوتوپ : منابع : کاربرد : به عنوان پوشش حرارتی در پیلهای خورشیدی و پوشش آئینه ها ودر فعالیتهای هسته ای و تحقیقات خون و ریه بکار میرود.روش شناسایی:
کاربر فعال تالار شیمی
کاربر ممتاز
اثرات تالیم بر روی سلامتی اثرات زیست محیطی تالیم خواص فیزیکی و شیمیایی عنصر تالیم ایزوتوپ : اشکال دیگر : منابع : کاربرد : كربن ( Carbon )
اثرات کربن در سلامتي انسان اثرات زيست محيطي کربن تجهیزات آزمایشگاهی مورد استفاده در تجزیه خواص فیزیکی و شیمیایی عنصر کربن : منابع : کاربرد :
کاربر فعال تالار شیمی
کاربر ممتاز
سيليس - سیلیسیم ( Silicon )
اثرات سيليسيم بر محيط زيست تجهیزات آزمایشگاهی مورد استفاده در تجزیه خواص فیزیکی و شیمیایی عنصر سیلیسیم : ایزوتوپ : اشکال دیگر : ژرمانیم ( Germanium )
اثرات زیست محیطی ژرمانیم تجهیزات آزمایشگاهی مورد استفاده در تجزیه خواص فیزیکی و شیمیایی عنصر ژرمانیم : ایزوتوپ : اشکال دیگر : روش شناسایی:
کاربر فعال تالار شیمی
کاربر ممتاز
قلع ( Tin )
اثرات قلع بر روی سلامتی اثرات زیست محیطی قلع خواص فیزیکی و شیمیایی عنصر قلع : اشکال دیگر : منابع : کاربرد : روش شناسایی:
کاربر فعال تالار شیمی
کاربر ممتاز
سرب یکی از عنصرهای شیمیایی واسطه در جدول تناوبی است. سرب همچنین در رده فلزها قرار دارد. تاثیر سرب بر سلامتی جداسازی
کاربر فعال تالار شیمی
کاربر ممتاز
نیتروژن ( Nitrogen )
اثرات زيست محيطي نيتروژن تجهیزات آزمایشگاهی مورد استفاده در تجزیه خواص فیزیکی و شیمیایی عنصر نیتروژن : ایزوتوپ : اشکال دیگر : کاربرد: منابع : فسفر ( Phosphorus )
اثرات فسفر بر سلامتي انسان اثرات فسفر بر محيط زيست تجهیزات آزمایشگاهی مورد استفاده در تجزیه ایزوتوپ : اشکال دیگر : منابع : کاربرد :
کاربر فعال تالار شیمی
کاربر ممتاز
خواص فیزیکی و شیمیایی عنصر آرسنیک : ایزوتوپ : اشکال دیگر : منابع : آنتیموان ( Antimony )
آنتیموآن یک عنصر جامد شبه فلزاست که به رنگ سیاه تا خاکستری می باشد . دارای ساختار رومبوئدرال می باشد . این اثرات زیست محیطی آنتیموان
خواص فیزیکی و شیمیایی عنصر آنتیموان : ایزوتوپ : اشکال دیگر : منابع : کاربرد :
کاربر فعال تالار شیمی
کاربر ممتاز
اثرات بیسموت بر روی سلامتی اثرات زیست محیطی بیسموت خواص فیزیکی و شیمیایی عنصر بیسموت : ایزوتوپ : اشکال دیگر : منابع : کاربرد : در داروسازی ، در ساخت مواد منفجره ، پاک کننده ها ، شیشه ، سرامیک ، در تولید سوهان وبه عنوان کاتالیزور در
________________________________________________________________
اکسیژن ( Oxygen )
اثرات زيست محيطي اکسيژن تجهیزات آزمایشگاهی مورد استفاده در تجزیه خواص فیزیکی و شیمیایی عنصر اکسیژن : ایزوتوپ : اشکال دیگر : منابع : کاربرد :
کاربر فعال تالار شیمی
کاربر ممتاز
اثرات گوگرد بر سلامتي انسان اثرات گوگرد بر محيط زيست خواص فیزیکی و شیمیایی عنصر گوگرد : ایزوتوپ : اشکال دیگر : کاربرد: منابع : سلنیم ( Selenium )
اثرات سلنیم بر روی سلامتی اثرات زیست محیطی سلنیم : خواص فیزیکی و شیمیایی عنصر سلنیم : اشکال دیگر : منابع : کاربرد :
کاربر فعال تالار شیمی
کاربر ممتاز
اثرات تلوریم بر روی سلامتی اثرات زیست محیطی تلوریم
تجهیزات آزمایشگاهی مورد استفاده در تجزیه خواص فیزیکی و شیمیایی عنصر تلوریم : ایزوتوپ : اشکال دیگر : منابع : پولونيم ( Polonium )
اثرات پولونیم بر روی سلامتی اثرات زیست محیطی پولونیم خواص فیزیکی و شیمیایی عنصر پولونیم : ایزوتوپ : اشکال دیگر : منابع : کاربرد :
کاربر فعال تالار شیمی
کاربر ممتاز
اثرات فلوئور بر سلامتي انسان تجهیزات آزمایشگاهی مورد استفاده در تجزیه خواص فیزیکی و شیمیایی عنصر فلوئور : ایزوتوپ : اشکال دیگر : منابع : کاربرد : کلر ( Chlorine )
اثرات کلر بر سلامتي انسان تاثيرات زيست محيطي کلر تجهیزات آزمایشگاهی مورد استفاده در تجزیه خواص فیزیکی و شیمیایی عنصر کلر : ایزوتوپ : اشکال دیگر : منابع : کاربرد : از کلر در تصفیه آب ، سفید کننده ها و دیگر ترکیباتی نظیر CFC ها استفاده می شود .
کاربر فعال تالار شیمی
کاربر ممتاز
اثرات برم بر روی سلامتی اثرات زیست محیطی برم خواص فیزیکی و شیمیایی عنصر برم : ایزوتوپ : اشکال دیگر : کاربرد : ید ( Iodine )
اثرات زیست محیطی ید تجهیزات آزمایشگاهی مورد استفاده در تجزیه خواص فیزیکی و شیمیایی عنصر ید : ایزوتوپ : اشکال دیگر : منابع : کاربرد : استاتین ( Astatine )
اثرات استاتین بر روی سلامتی اثرات زیست محیطی استاتین خواص فیزیکی و شیمیایی عنصر استاتین : ایزوتوپ : اشکال دیگر : منابع :
کاربر فعال تالار شیمی
کاربر ممتاز
هلیم ( Helium )
اثرات هليم در سلامتي انسان ایزوتوپ : موارد استفاده : منابع : نئون ( Neon )
اثرات نئون بر سلامتي انسان اثرات نئون بر محيط زيست خواص فیزیکی و شیمیایی و عنصر نئون : ایزوتوپ : منابع :
کاربر فعال تالار شیمی
کاربر ممتاز
اثرات آرگون بر سلامتي انسان تجهیزات آزمایشگاهی مورد استفاده در تجزیه خواص فیزیکی و شیمیایی عنصر آرگون : ایزوتوپ : منابع : کاربرد : کریپتون ( Krypton )
اثرات کریپتون بر روی سلامتی خواص فیزیکی و شیمیایی عنصر کریپتون : موارد استفاده : منابع :
کاربر فعال تالار شیمی
کاربر ممتاز
زنون ( Xenon )
اثرات زنون بر روی سلامتی اثرات زیست محیطی زنون تجهیزات آزمایشگاهی مورد استفاده در تجزیه خواص فیزیکی و شیمیایی عنصر زنون : ایزوتوپ : اشکال دیگر : منابع : کاربرد : رادون ( Radon )
اثرات رادون بر روی سلامتی اثرات زیست محیطی رادون خواص فیزیکی و شیمیایی عنصر رادون : ایزوتوپ : کاربرد: منابع :
کاربر فعال تالار شیمی
کاربر ممتاز
سریم ( Cerium )
اثرات سریم بر روی سلامتی اثرات زیست محیطی سریم خواص فیزیکی و شیمیایی عنصر سریم : ایزوتوپ : اشکال دیگر : منابع : کاربرد : پراسیودیمیم ( Praseodymium )
اثرات پراسیوديميم بر روی سلامتی اثرات زیست محیطی پراسیوديميم خواص فیزیکی و شیمیایی عنصر پراسیودیمیم : ایزوتوپ : اشکال دیگر : منابع : کاربرد :
کاربر فعال تالار شیمی
کاربر ممتاز
اثرات نیودیمیم بر روی سلامتی اثرات زیست محیطی نیودیمیم تجهیزات آزمایشگاهی مورد استفاده در تجزیه ایزوتوپ : اشکال دیگر : منابع : کاربرد : پرومتیم ( Promethium )
اثرات پرومتیم بر روی سلامتی تجهیزات آزمایشگاهی مورد استفاده در تجزیه خواص فیزیکی و شیمیایی عنصر پرومتیم : ایزوتوپ : اشکال دیگر : منابع : کاربرد :
آخرین ویرایش: Jul 23, 2012
کاربر فعال تالار شیمی
کاربر ممتاز
ساماریم ( Samarium )
اثرات ساماریم بر روی سلامتی اثرات زیست محیطی ساماریم تجهیزات آزمایشگاهی مورد استفاده در تجزیه خواص فیزیکی و شیمیایی عنصر ساماریم : ایزوتوپ : اشکال دیگر : منابع : کاربرد : اروپیم ( Europium )
اثرات زیست محیطی اروپیم خواص فیزیکی و شیمیایی عنصر اروپیم : ایزوتوپ : اشکال دیگر : منابع : کاربرد : این عنصر به همراه اکسید ایتریم برای ایجاد رنگ قرمز در صفحه تلویزیون به کار می رود . همچنین در ساخت آلیاژ نیز کاربرد دارد .
کاربر فعال تالار شیمی
کاربر ممتاز
گادولینیم ( Gadolinium )
اثرات گادولینیم بر روی سلامتی اثرات زیست محیطی گادولینیم تجهیزات آزمایشگاهی مورد استفاده در تجزیه خواص فیزیکی و شیمیایی عنصر گادولینیم : ایزوتوپ : اشکال دیگر : منابع : کاربرد : تربیم ( Terbium )
اثرات تربیم بر روی سلامتی اثرات زیست محیطی تربیم خواص فیزیکی و شیمیایی عنصر تربیم : ایزوتوپ : اشکال دیگر : منابع : کاربرد :
کاربر فعال تالار شیمی
کاربر ممتاز
اثرات دیسپروزیم بر روی سلامتی اثرات زیست محیطی دیسپروزیم تجهیزات آزمایشگاهی مورد استفاده در تجزیه خواص فیزیکی و شیمیایی عنصر دیسپروزیم : ایزوتوپ : اشکال دیگر : کاربرد : هولمیم (Holmium )
اثرات هولمیم بر روی سلامتی اثرات زیست محیطی هولمیم خواص فیزیکی و شیمیایی عنصر هولمیم : ایزوتوپ : اشکال دیگر : منابع : کاربرد :
کاربر فعال تالار شیمی
کاربر ممتاز
اربیم خالص به شکل نرم ، چکش خوار و درخشان و به رنگ نقره ای متالیک است . این فلز در هوا نسبتاً پایدار بوده و به سرعت اکسید نمی شود . از اثرات اربیم بر روی سلامتی اثرات زیست محیطی اربیم تجهیزات آزمایشگاهی مورد استفاده در تجزیه خواص فیزیکی و شیمیایی عنصر اربیم : ایزوتوپ : اشکال دیگر : منابع : کانی های کمیاب سنگین و کانی های مونازیت و باستنازیتکاربرد : تولیم ( Thulium )
کشف این عنصر توسط Per Theodor Cleve و در سال 1897 در سوئد انجام گرفت و علت نامگذاری آن نام قدیم اسکاندیناوی است .توليم کمياب ترين اثرات تولیم بر روی سلامتی خواص فیزیکی و شیمیایی عنصر تولیم : ایزوتوپ : اشکال دیگر : کاربرد : منابع : کانی های گادولینیت ، یوکسنیت ، زنوتایم ، مونازیت و باستنازیت
کاربر فعال تالار شیمی
کاربر ممتاز
اثرات ایتربیم بر روی سلامتی اثرات زیست محیطی ایتربیم خواص فیزیکی و شیمیاییی عنصر ایتربیم : 6 ایزوتوپ : اشکال دیگر : کاربرد : مورد استفاده در آزمایشهای شیمیایی و متالورژیکی و ساخت آلیاژها منابع : کانی های ایتریا ، مونازیت ، گادولینیت ، زنوتایم و باستنازیتلوتتیم ( Lutetium )
کشف این عنصر توسط Georges Urbain و در سال 1907 در فرانسه انجام گرفت و علت نامگذاری آن بر گرفته از نام قدیم فرانسه است .در سال 1907 ، اثرات لوتتیم بر روی سلامتی اثرات زیست محیطی لوتتیم خواص فیزیکی و شیمیایی عنصر لوتتیم : ] ایزوتوپ : اشکال دیگر : کاربرد : منابع :
کاربر فعال تالار شیمی
کاربر ممتاز
>> اکتینیدها <<
اثرات توریم بر روی سلامتی اثرات زیست محیطی توریم تجهیزات آزمایشگاهی مورد استفاده در تجزیه . خواص فیزیکی و شیمیایی عنصر توریم : ایزوتوپ : اشکال دیگر : کاربرد :منابع : پروتاکتینیم ( Protactinium )
این عنصر توسط دانشمندان Fredrich Soddy / John Cranston / Otto Hahn / Lise Meitner و در سال 1917 مشترکاً در انگلیس و فرانسه صورت گرفت . اثرات پروتاکتینیم بر روی سلامتی اثرات زیست محیطی پروتاکتینیم تجهیزات آزمایشگاهی مورد استفاده در تجزیه . خواص فیزیکی و شیمیایی عنصر پروتاکتینیم : ایزوتوپ : اشکال دیگر : منابع :
کاربر فعال تالار شیمی
کاربر ممتاز
کشف این عنصر توسط Martin Klaproth و در سال 1789 در آلمان رخ داد و اسم این عنصر از نام سیاره اورانوس برگرفته شده است . اثرات اورانیم بر روی سلامتی اثرات زیست محیطی اورانیم خواص فیزیکی و شیمیایی عنصر اورانیم : ایزوتوپ : اشکال دیگر : کاربرد : منابع : نپتونیم ( Neptunium )
اثرات نپتونیم بر روی سلامتی اثرات زیست محیطی نپتونیم تجهیزات آزمایشگاهی مورد استفاده در تجزیه خواص فیزیکی و شیمیایی عنصر نپتونیم : ایزوتوپ : اشکال دیگر : منابع :
کاربر فعال تالار شیمی
کاربر ممتاز
این عنصر توسط G.T.Seaborg / A.Ghiorso / R.A.James / L.O. Morgan و در سال 1945 در ایالات متحده آمریکا کشف شد . اثرات امریکیم بر روی سلامتی اثرات زیست محیطی امریکیم خواص فیزیکی و شیمیایی عنصر آمریکیم : ایزوتوپ : منابع : کوریم ( Curium )
3 دانشمند دیگر یک ترکیبی از این عنصر با خاصیت مغناطیسی بالا با فرمول CmF3 را پیدا کردند که این ترکیب از نظر خاصیت مغناطیسی اثرات کوریم بر روی سلامتی م 244 از راه تزریق وریدی وارد بدن آنها شده بود، سرطان استخوان مشاهده شد و در موشهایی که از راه تنفس آلودهاثرات زیست محیطی کوریم خواص فیزیکی و شیمیایی عنصر کوریم : ایزوتوپ : اشکال دیگر : کاربرد : منابع :
کاربر فعال تالار شیمی
کاربر ممتاز
اثرات برکلیم بر روی سلامتی اثرات زیست محیطی برکلیم تجهیزات آزمایشگاهی مورد استفاده در تجزیه خواص فیزیکی و شیمیایی عنصر برکلیم : ایزوتوپ : اشکال دیگر : منابع : کالیفرنیم ( Californium )
اثرات کالیفرنیم بر روی سلامتی خواص فیزیکی و شیمیایی عنصر کالیفرنیم : ایزوتوپ : اشکال دیگر : کاربرد : منابع : اینشتینیم ( Einsteinium )
این عنصر توسط Argonne / Los Alamos / Uofcalif و در سال 1925 در آمریکا کشف شد . نام این عنصر به افتخار آلبرت انیشتین روی آن نهاده شده اثرات اینشتینیم بر روی سلامتی اثرات زیست محیطی اینشتینیم خواص فیزیکی و شیمیایی عنصر اینشتینیم : ایزوتوپ : اشکال دیگر : منابع :
فرمیم ( Fermium )
این عنصر توسط Los Alamos / Argonne / Uofcalif در آمریکا و در سال 1953 کشف شد . نام آن به افتخار دانشمند معروف انریکو فرمی ( فرمیم (انریکو فرمی)، هشتمین عنصرسری آکتینیدهاست که دارای عدد اتمی بیشتر از اورانیوم می باشد و توسط گیویرسو و همکارانش در ایزوتوپ تولید شده فرمیم 255 و 20 ساعته بود. در سال 1953 و اوایل سال 1954، هنگامی که از کشف عناصر 99 و 100 به خاطر مسائل بر روی ویژگیهای شیمیایی فرمیم مطالعات اندکی انجام شده است. در واسطه های آبی نرمال، تنها حالت اکسید فرمیم III وجود دارد. فرمیم 254 و ایزوتوپهای سنگین تر آن در اثر تابش شدید نوترونی عناصر پایینتر مانند پلوتونیم به وجود می آیند و تولید آنها از طریق فرآیند در حال حاضر 16 ایزوتوپ فرمیم شناسایی شده اند. فرمیم 257، با نیمه عمر حدود 100.5 روز، بیشترین نیمه عمر را دارد. فرمیم 250 با نیمه
بعدی 252 Fmاثرات فرمیم بر روی سلامتی : فرمیم به طور طبیعی وجود ندارد و در پوسته زمین یافت نمی شود بنابراین لزومی ندارد که اثرات آن را بر روی سلامتی بررسی کنیم.
عنصر Fm در طبيعت اثرات زیست محیطی فرمیم : فرمیم به طور طبیعی وجود ندارد و در پوسته زمین یافت نمی شود بنابراین لزومی ندارد که اثرات آن را بر روی محیط زیست بررسی کنیم. تجهیزات آزمایشگاهی مورد استفاده در تجزیه : اسپکترومتر جرمی ، میکروسکوپ ، کرماتوگرافی مایع و گازی ، اشعه x ، جذب اتمی ، مادون قرمز ، کروماتوگرافی مایع با عملکرد بالا و خواص فیزیکی و شیمیایی عنصر فرمیم : عدد اتمی:100 جرم اتمی:257.0951 نقطه ذوب : C°860 شعاع فلزی : pm290 ظرفیت:3 حالت استاندارد: رادیو اکتیو نام گروه:اکتنید انرژی یونیزاسیون :Kj/mol 630 شکل الکترونی : Rn5f117s2 الکترونگاتیوی:1.2 حالت اکسیداسیون:3 دوره تناوبی :7 شماره سطح انرژی : 7 اولین انرژی : 2 دومین انرژی : 8 سومین انرژی : 18 چهارمین انرژی : 32 پنجمین انرژی : 30 ششمین انرژی : 8 هفتمین انرژی : 2 ایزوتوپ : ایزوتوپ نیمه عمر Fm-249 3.0 دقیقه منابع : بدست بشر ساخته شده است .
مندلویم ( Mendelevium )
این عنصر توسط A.Ghiorso / S.G.Tompson / G.T.Seaborg / K.Street Jr. و در سال 1955 در آمریکا کشف شد و نام آن به افتخار مندلیف ( Dmitri Ivanvitch Mendeleyev) ) نامگذاری شده است .
: خواص فیزیکی و شیمیایی عنصر مندلویم : C° 827 ایزوتوپ :
ـــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــ
نوبلیم ( Nobelium )
این عنصر توسط انسیتو نوبل فیزیک و در سال 1957 در سوئد کشف شد و به افتخار آلفرد نوبل کاشف دینامیت نامگذاری شد .
اثرات نوبلیم بر روی سلامتی : اثرات زیست محیطی نوبلیم : تجهیزات آزمایشگاهی مورد استفاده در تجزیه : خواص فیزیکی و شیمیایی عنصر نوبلیم : ایزوتوپ : منابع : بدست بشر ساخته شده است .
ــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــ
لورنسیم ( Lawrencium )
این عنصر توسط T.Sik Keland / A.Ghiorso / A.E.Larsh / R.M.Latimer و در سال 1961 در آمریکا کشف شد و نامگذاری آن به افتخار ارنست اولاورنس اثرات لورنسیم بر روی سلامتی : اثرات زیست محیطی لورنسیم : تجهیزات آزمایشگاهی مورد استفاده در تجزیه : خواص فیزیکی و شیمیایی عنصر لورنسیم : ایزوتوپ : منابع : بدست بشر ساخته شده است .
Dmitri Mendeleev ,
1834 - 1907